鉛蓄電池是最常見的二次電池,以廢舊鉛蓄電池中的鉛膏(主要含PbO、PbO2、PbSO4等)為原料回收鉛,對保護環境和發展循環經濟意義重大。某工藝流程如圖1:
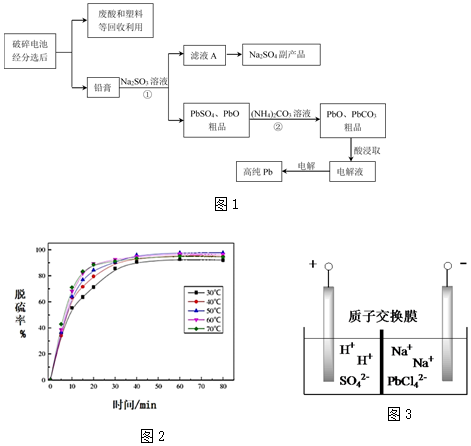
(1)已知鉛蓄電池總反應:Pb+PbO2+2H2SO4放電充電2PbSO4+2H2O,充電時,陽極的電極反應式為PbSO4-2e-+2H2O=PbO2+4H++SO42-PbSO4-2e-+2H2O=PbO2+4H++SO42-。
(2)過程①體現Na2SO3的還原還原性。
(3)由濾液A可獲得Na2SO4?10H2O粗品,檢驗粗品中SO42-離子的實驗方法是取少量晶體,加足量鹽酸,再滴加BaCl2溶液,若產生白色沉淀,則陰離子為SO42-取少量晶體,加足量鹽酸,再滴加BaCl2溶液,若產生白色沉淀,則陰離子為SO42-。
(4)結合化學用語解釋過程②中PbSO4轉化為PbCO3的原因PbSO4+CO32-=PbCO3+SO42-PbSO4+CO32-=PbCO3+SO42-。
(5)反應溫度對過程②轉化率(脫硫率)的影響如圖2所示,實際生產中溫度選擇在50℃,若溫度過高,脫硫率下降的原因可能是:溫度過高,碳酸銨分解溫度過高,碳酸銨分解。
(6)將PbO、PbCO3粗品置于一定濃度HCl和NaCl浸取液中溶解,得到含Na2PbCl4的電解液,如圖3電解可得高純Pb,同時再生浸取液。請結合化學用語解釋浸取液再生的原理陰極PbCl42-+2e-=Pb+4Cl-,H+離子在電壓作用下穿過質子交換膜向陰極室定向移動,形成HCl和NaCl混合液陰極PbCl42-+2e-=Pb+4Cl-,H+離子在電壓作用下穿過質子交換膜向陰極室定向移動,形成HCl和NaCl混合液。
放電
充電
【答案】PbSO4-2e-+2H2O=PbO2+4H++SO42-;還原;取少量晶體,加足量鹽酸,再滴加BaCl2溶液,若產生白色沉淀,則陰離子為SO42-;PbSO4+CO32-=PbCO3+SO42-;溫度過高,碳酸銨分解;陰極PbCl42-+2e-=Pb+4Cl-,H+離子在電壓作用下穿過質子交換膜向陰極室定向移動,形成HCl和NaCl混合液
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:103引用:1難度:0.6
相似題
-
1.某原電池結構如圖所示,下列有關該原電池的說法正確的是( )
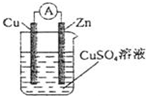
A.銅棒為負極 B.鋅棒發生還原反應 C.電子從銅棒經外電路流向鋅棒 D.鋅棒質量減輕 發布:2025/1/6 6:0:5組卷:417引用:11難度:0.9 -
2.關于如圖所示的原電池,下列說法正確的是( )
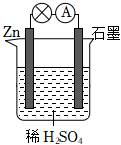
A.石墨電極上發生氧化反應 B.電子由鋅片通過導線流向石墨棒 C.該裝置將電能轉化為化學能 D.將稀硫酸換成乙醇,燈泡亮度不變 發布:2025/1/6 6:0:5組卷:84引用:6難度:0.8 -
3.一種新型短路膜電化學電池消除CO2裝置如圖所示。下列說法錯誤的是( )
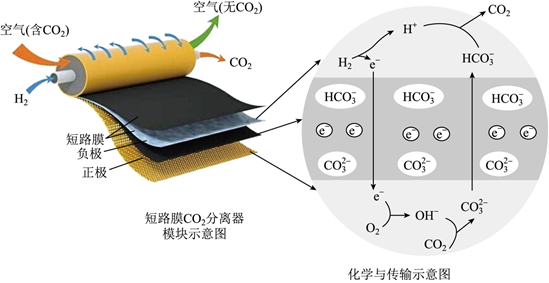
A.負極反應為:H2+2OH--2e-=2H2O B.正極反應消耗標準狀況下22.4LO2,理論上需要轉移4mol電子 C.短路膜和常見的離子交換膜不同,它既能傳遞離子,還可以傳遞電子 D.該裝置可用于空氣中CO2的捕獲,緩解溫室效應 發布:2024/12/30 19:30:2組卷:51引用:5難度:0.5
相關試卷


