某研究小組為探究弱酸性條件下鐵發生電化學腐蝕類型的影響因素,將混合均勻的新制鐵粉和碳粉置于錐形瓶底部,塞上瓶塞(如圖1)。從膠頭滴管中滴入幾滴醋酸溶液,同時測量容器中的壓強變化。
(1)請完成以下實驗設計表(表中不要留空格):
| 編號 | 實驗目的 | 碳粉/g | 鐵粉/g | 醋酸/% |
| ① | 為以下實驗作參照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸濃度的影響 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
吸氧
吸氧
腐蝕,請在圖3中用箭頭標出發生該腐蝕時電子流動方向 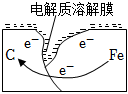

還原
還原
(填“氧化”或“還原”)反應,其電極反應式是 O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
。
(3)該小組對圖2中0-t1時壓強變大的原因提出了如下假設,請你完成假設二:假設一:發生析氫腐蝕產生了氣體;
假設二:
反應放熱使錐形瓶內溫度升高
反應放熱使錐形瓶內溫度升高
;…
(4)為驗證假設一,某同學設計了檢驗收集的氣體中是否含有H2的方案,請你再設計一個實驗方案驗證假設一,寫出實驗步驟和結論。
【考點】探究原電池及其工作原理.
【答案】吸氧; ;還原;O2+2H2O+4e-═4OH-;反應放熱使錐形瓶內溫度升高
;還原;O2+2H2O+4e-═4OH-;反應放熱使錐形瓶內溫度升高
 ;還原;O2+2H2O+4e-═4OH-;反應放熱使錐形瓶內溫度升高
;還原;O2+2H2O+4e-═4OH-;反應放熱使錐形瓶內溫度升高【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:418引用:7難度:0.1
相似題
-
1.實驗小組探究鋁片做電極材料時的原電池反應,設計下表中裝置進行實驗并記錄。
【實驗1】
(1)實驗1中,電解質溶液為鹽酸,鎂條做原電池的裝置 實驗現象 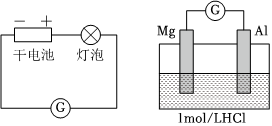
左側裝置電流計指針向右偏轉,燈泡亮
右側裝置電流計指針向右偏轉,鎂條、鋁條表面產生無色氣泡極。
【實驗2】將實驗1中的電解質溶液換為NaOH溶液進行實驗2。
(2)該小組同學認為,此時原電池的總反應為2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,據此推測應該出現的實驗現象為。
實驗2實際獲得的現象如下:
(3)ⅰ中鋁條表面放電的物質是溶解在溶液中的O2,則該電極反應式為裝置 實驗現象 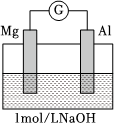
ⅰ.電流計指針迅速向右偏轉,鎂條表面無氣泡,鋁條表面有氣泡
ⅱ.電流計指針逐漸向零刻度恢復,經零刻度后繼續向左偏轉。鎂條表面開始時無明顯現象,一段時間后有少量氣泡逸出,鋁條表面持續有氣泡逸出。
(4)ⅱ中“電流計指針逐漸向零刻度恢復”的原因是。
【實驗3和實驗4】
為了排除Mg條的干擾,同學們重新設計裝置并進行實驗3和實驗4,獲得的實驗現象如下:
(5)根據實驗3和實驗4可獲得的正確推論是編號 裝置 實驗現象 實驗3 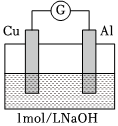
電流計指針向左偏轉。鋁條表面有氣泡逸出,銅片沒有明顯現象;約10分鐘后,銅片表面有少量氣泡產生,鋁條表面氣泡略有減少。 實驗4 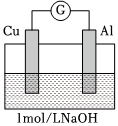
煮沸冷卻后的溶液電流計指針向左偏轉。鋁條表面有氣泡逸出,銅片沒有明顯現象:約3分鐘后,銅片表面有少量氣泡產生,鋁條表面氣泡略有減少。 (填字母序號)。
A.上述兩裝置中,開始時銅片表面得電子的物質是O2
B.銅片表面開始產生氣泡的時間長短與溶液中溶解氧的多少有關
C.銅片表面產生的氣泡為H2
D.由“鋁條表面氣泡略有減少”能推測H+在銅片表面得電子
(6)由實驗1~實驗4可推知,鋁片做電極材料時的原電池反應與等因素有關。發布:2024/9/20 0:0:11組卷:121引用:4難度:0.5 -
2.某化學興趣小組為了探索Al電極在原電池中的作用,設計并進行了以下一系列實驗,實驗結果記錄如表。
根據如表中的實驗現象完成下列問題:編號 電極材料 電解質溶液 電流計指針偏轉方向 ① Mg Al 稀鹽酸 偏向Al ② Al Cu 稀鹽酸 偏向Cu ③ Mg Al NaOH溶液 偏向Mg
(1)實驗1、2的Al所作的電極是否相同?,由此說明在原電池中金屬鋁作正極還是負極與有關。
(2)寫出實驗2中的電極反應式和電池總反應方程式。
(3)實驗3中的鋁作正極還是負極?鋁電極 銅電極 電池總反應 ,為什么?。
(4)實驗3的結果引起了興趣小組的重視,他們以Al、Zn為電極材料,濃硝酸為電解質溶液組成了一套裝置,請結合實驗3的結果推斷電流計指針的偏轉方向應為,原因是。
(5)根據實驗結果總結:在原電池中金屬鋁作正極還是負極受到哪些因素的影響?。發布:2024/6/27 10:35:59組卷:21引用:1難度:0.5 -
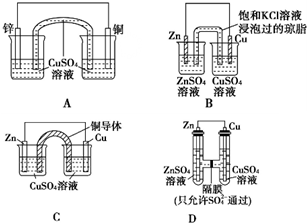 3.某化學興趣小組對原電池中鹽橋的作用進行探究,并設計了以下實驗裝置:
3.某化學興趣小組對原電池中鹽橋的作用進行探究,并設計了以下實驗裝置:
(1)以上四個裝置中,能發揮鹽橋作用的是
(2)若以A、B為電源,分別電解等濃度、等體積的NaCl溶液,當消耗等質量Zn時,產生的H2(填“A”或“B”)多,原因是
(3)如果C裝置中U形銅導體在插入溶液前是粗細均勻的,插入足夠長時間后,仔細比較兩端的變化是.
(4)D裝置充分作用后,左側溶液中的濃度SO2-4(填“=”“>”或“<”)右側的濃度.SO2-4發布:2024/12/11 8:0:1組卷:26引用:0難度:0.9


