硫酸是最重要的化工產品之一,工業制硫酸的主要原料有硫鐵礦、硫黃、冶煉煙氣等.
(1)寫出硫鐵礦煅燒制備SO2的化學方程式 4FeS2+11O2 煅燒 2Fe2O3+8SO24FeS2+11O2 煅燒 2Fe2O3+8SO2.SO2氧化成SO3使用的催化劑名稱是 五氧化二釩五氧化二釩.最后用 98.3%的濃硫酸98.3%的濃硫酸來吸收三氧化硫.
(2)煅燒10噸純度90%的硫鐵礦(設雜質不參加反應),理論上至少需要空氣的體積(標準狀況)為 2.31×1072.31×107L(空氣中N2、O2的體積分數分別為0.80和0.20),若SO2轉化率95%,最后可以制得98%的硫酸 14.2514.25噸.
(3)硫酸生產工藝中下列說法正確的是(選填序號字母) ABCDABCD.
A.為使硫鐵礦充分燃燒,需將其粉碎
B.沸騰爐出來的氣體必須凈化的主要原因是防止催化劑中毒
C.沸騰爐排出的礦渣可供煉鐵
D.SO2進行轉化時轉化器和熱交換器合為一體
(4)硫鐵礦制硫酸會產生大量“三廢”,必須進行治理.處理廢氣中的SO2常用下列方法:
①氨酸法
寫出用氨水吸收SO2至過量的化學方程式 SO2+2NH3?H2O=(NH4)2SO3+H2OSO2+2NH3?H2O=(NH4)2SO3+H2O、(NH4)2SO3+H2O+SO2=2NH4HSO3(NH4)2SO3+H2O+SO2=2NH4HSO3.產物可以再用硫酸處理,寫出反應的離子方程式 H++HSO3-=SO2↑+H2OH++HSO3-=SO2↑+H2O.產生的SO2既可作為生產硫酸的原料循環再利用,也可用于工業制溴過程中吸收潮濕空氣中的Br2,則SO2吸收Br2的離子方程式是 SO2+Br2+2H2O=4H++2Br-+SO42-SO2+Br2+2H2O=4H++2Br-+SO42-.
②石灰-石膏法
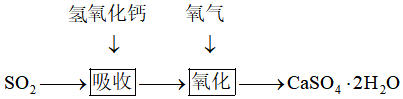
寫出流程圖中兩個反應的化學方程式 SO2+Ca(OH)2=CaSO3↓+H2OSO2+Ca(OH)2=CaSO3↓+H2O,2CaSO3+4H2O+O2=2CaSO4?2H2O2CaSO3+4H2O+O2=2CaSO4?2H2O.
(5)目前,我國以硫鐵礦制硫酸的比例不斷下降,用硫黃或冶煉煙氣作原料的優勢有 不產生廢渣和污水不產生廢渣和污水、成本較低成本較低等.
煅燒
煅燒
【考點】工業制取硫酸;化學方程式的有關計算.
【答案】4FeS2+11O2 2Fe2O3+8SO2;五氧化二釩;98.3%的濃硫酸;2.31×107;14.25;ABCD;SO2+2NH3?H2O=(NH4)2SO3+H2O;(NH4)2SO3+H2O+SO2=2NH4HSO3;H++HSO3-=SO2↑+H2O;SO2+Br2+2H2O=4H++2Br-+SO42-;SO2+Ca(OH)2=CaSO3↓+H2O;2CaSO3+4H2O+O2=2CaSO4?2H2O;不產生廢渣和污水;成本較低
煅燒
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:60引用:1難度:0.7
相似題
-
1.關于工業上用接觸法制硫酸的說法不正確的是( )
A.硫酸廠應建在靠近原料產地的地區 B.主要設備有沸騰爐、接觸室和吸收塔 C.三氧化硫不用水吸收,而是用濃硫酸吸收 D.尾氣若不經處理排放,有可能形成硫酸型酸雨 發布:2024/12/30 5:30:2組卷:28引用:3難度:0.7 -
2.硫酸在化工生產國民經濟發展中占有極其重要的地位,如圖是工業接觸法制硫酸的簡單流程圖。
試回答下列有關問題: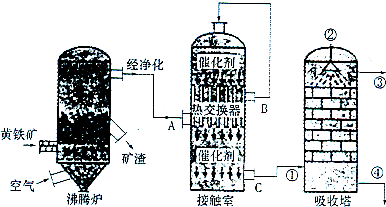
(1)寫出工業上用FeS2制取SO2的化學方程式;
(2)在硫酸工業生產過程中,需要考慮的因素很多,主要有生產原料的選擇與凈化反應條件和設備的選擇、;
(3)反應2SO2+O2?2SO3是在400~500℃條件下在接觸室中進行的,選擇這一反應條件的理由是在,在實際生產過程中進入接觸室的氣體中O2的體積分數是SO2體積分數的1.5倍,其原因是;
(4)硫酸工廠形成的“三廢”對環境有較大的影響,處理硫酸工廠尾氣的化學方程式是;
(5)下圖所示的裝置是仿照工業制備硫酸的工藝流程設計出來的,用于探究工業上為何采用98.3%的濃硫酸吸收三氧化硫;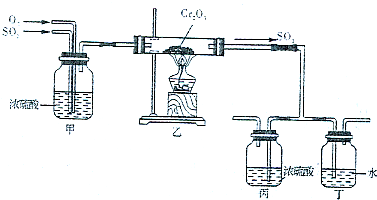
①若丁裝置在反應過程中出現氣泡,不久就出現了自霧,而丙裝置一直沒有明顯變化,丁裝置產生白霧的原因是,此現象對工業上制硫酸帶來的不良后果是;
②上圖中的乙裝置和丙裝置分別與工業制取硫酸的某個裝置相對應,其中乙裝置對應的是接觸室; 丙裝置對應的是。發布:2024/12/30 6:0:2組卷:12引用:2難度:0.5 -
3.有關接觸法制硫酸的敘述.其中不正確的是( )
A.用硫黃或含硫礦石均可作為原料 B.尾氣含有二氧化硫,在排入大氣前需進行凈化處理 C.接觸法制硫酸分為三個流程:硫黃或黃鐵礦→SO2;SO2→SO3;SO3→H2SO4 D.接觸法制硫酸的三個階段都在接觸室進行 發布:2024/12/30 6:0:2組卷:26引用:3難度:0.7


