從古至今,金屬及其化合物一直被人類廣泛應用。
一、金屬及其化合物的應用
(1)“三星堆遺址”出土了黃金面罩、象牙、青銅藝術品、殘存的絲織品等重要文物,其中屬于金屬材料的有 acac(選填序號)。
a.黃金面罩
b.象牙
c.青銅面具
d.絲織品
(2)《呂氏春秋?別類篇》載有“金(銅)柔錫柔,合兩柔則剛”,表明青銅的硬度比純銅 大大(選填“大”或“小”)。
(3)文物中的“黃金面罩”依然金光閃閃,而“青銅面具”則布滿銹斑,由此現象可知金的化學性質比銅更 不活潑不活潑(選填“活潑”或“不活潑”)。
(4)《淮南萬畢術》中記載“曾青得鐵則化為銅”,其反應原理可用化學方程式 Fe+CuSO4=FeSO4+CuFe+CuSO4=FeSO4+Cu表示。銅可與空氣中O2、H2O、CO2反應,在表面慢慢生成一層銅綠【Cu2(OH)2CO3】,寫出該反應的化學方程式 2Cu+CO2+H2O+O2=Cu2(OH)2CO32Cu+CO2+H2O+O2=Cu2(OH)2CO3。
二、用黃鐵礦(主要成分是FeS2,在空氣中焙燒生成Fe2O3和SO2,其雜質不溶于水且不參加反應)制備氯化鐵晶體主要流程如圖:
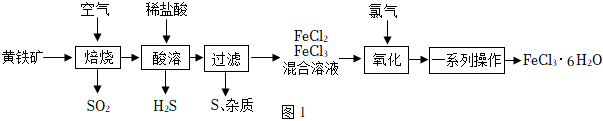
(5)SO2的排放會導致酸雨,酸雨是指pH<5.65.6的降雨。
(6)酸溶的化學方程式 Fe2O3+6HCl=2FeCl3+3H2OFe2O3+6HCl=2FeCl3+3H2O。焙燒殘留的FeS2與稀鹽酸反應生成H2S、S,寫出該反應的化學方程式 FeS2+2HCl=FeCl2+H2S+S↓FeS2+2HCl=FeCl2+H2S+S↓。
(7)“一系列操作”包括:蒸發濃縮、降溫結晶降溫結晶、過濾等。
(8)以下措施不能提高FeCl3?6H2O產率的是 dd(選填序號)。
a.把黃鐵礦研磨成粉末
b.延長稀鹽酸溶解時間
c.把過濾、洗滌后的濾液加入混合溶液
d.氧化時加熱到持續沸騰
三、紅褐色固體的熱重分析:
蒸發氯化鐵溶液獲得了紅褐色固體。經查閱資料獲知,該固體是Fe(OH)3和堿式氯化鐵晶體[Fe(OH)Cl2?xH2O]的混合物。稱取紅褐色固體7.18g,在科研人員的指導下用圖2裝置進行熱分解實驗。
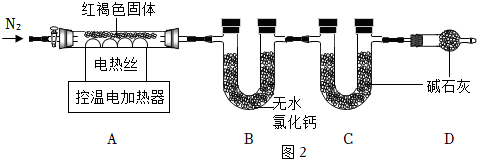
【查閱資料】
①堿式氯化鐵晶體在50℃時開始分解,在200℃完全分解為Fe2O3、H2O、HCl。
②在500℃時,Fe(OH)3分解為Fe2O3。
③無水氯化鈣為干燥劑,不吸收HCl氣體。
(9)加熱前后及過程中均通入N2,200℃加熱后通N2的目的是 使生成的H2O、HCl分別能全部被B和C裝置吸收,減少實驗誤差使生成的H2O、HCl分別能全部被B和C裝置吸收,減少實驗誤差。
(10)控制不同的溫度對裝置A中固體加熱,測得裝置B、C中的質量變化如表:
| 溫度/℃ | 室溫 | 220 | 520 |
| B裝置/g | 200.00 | 201.98 | m |
| C裝置/g | 200.00 | 201.46 | 201.46 |
202.52
202.52
。②原紅褐色固體中各成分的質量比為
107:252
107:252
。③x=
6
6
。【答案】ac;大;不活潑;Fe+CuSO4=FeSO4+Cu;2Cu+CO2+H2O+O2=Cu2(OH)2CO3;5.6;Fe2O3+6HCl=2FeCl3+3H2O;FeS2+2HCl=FeCl2+H2S+S↓;降溫結晶;d;使生成的H2O、HCl分別能全部被B和C裝置吸收,減少實驗誤差;202.52;107:252;6
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/7 8:0:9組卷:173引用:2難度:0.5
相似題
-
1.新冠肺炎疫情防控期間,西安市各學校開展全域噴灑低濃度、有效成分是次氯酸鈉的“84”消毒液進行消毒。如圖所示是模擬制備“84”消毒液的流程(Cl2是一種黃綠色的有毒氣體)。請回答下列問題:
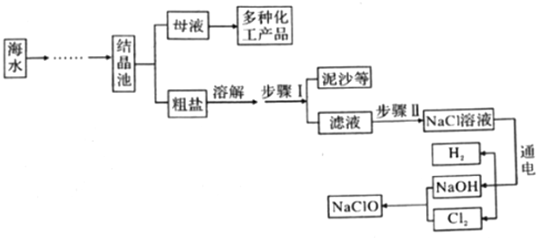
(1)NaOH的俗稱為(寫一種)。
(2)步驟Ⅱ中,通常用碳酸鈉溶液除去濾液中的氯化鈣雜質,請寫出有關反應的化學方程式。
(3)電解水時,一般在水中加入少量NaOH以增強水的導電性,不能加入NaCl的原因是。發布:2025/1/3 8:0:1組卷:6引用:1難度:0.5 -
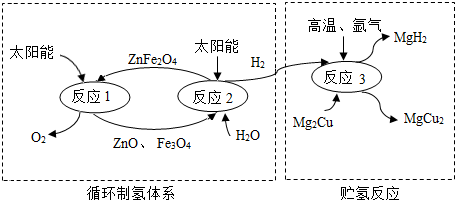 2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )
2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )A.ZnFe2O4中Fe的化合價為+3價 B.循環制氫反應中無需加入ZnFe2O4 C.反應1和反應2的總方程式為:2H2O 2H2↑+O2↑通電D.M與足量稀鹽酸反應生成的H2質量大于反應2產生的H2質量 發布:2024/12/31 8:0:1組卷:48引用:2難度:0.5 -
3.某種家用的消毒液的主要成分是次氯酸鈉(NaClO),制取NaClO的化學方程式為:Cl2+2NaOH=NaClO+NaCl+H2O,下列說法錯誤的是( )
A.NaClO中氯元素的化合價為-1 B.反應中用到的NaOH俗稱燒堿 C.該化學方程式中涉及到兩種鹽 D.反應前后氯元素化合價既升高又降低 發布:2025/1/3 8:0:1組卷:71引用:1難度:0.7


