已知木炭還原氧化銅實驗中發生的主要反應:C+2CuO 高溫 2Cu+CO2↑,某化學興趣小組對該實驗紅色固體產物的成分(假設反應物已完全反應)作如下探究:
探究一:檢驗紅色固體產物的成分
【查閱資料】
Ⅰ.木炭還原氧化銅除生成銅外還可能生成氧化亞銅(Cu2O);
Ⅱ.Cu和Cu2O均為不溶于水的紅色固體;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
【提出問題】該實驗的紅色固體產物中含有什么物質?
【猜想與假設】
假設1:紅色固體只含Cu;
假設2:紅色固體只含Cu2O;
假設3:紅色固體Cu、Cu2O的混合物紅色固體Cu、Cu2O的混合物(請補充完成假設3)。
【實驗探究】(填寫表中空格)
高溫
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取少量紅色固體加入到足量稀硫酸溶液中 | 若無明顯現象 | 假設1成立 |
| 若固體 部分 部分 (選填“全部”或“部分”)溶解,溶液由無色變藍色 |
假設2和假設3均成立 |
該化學興趣小組經交流討論后,設計了如下兩方案:
【方案一】稱取5.00g紅色固體加入到足量稀硫酸溶液中使其充分反應后,操作A、洗滌、干燥,稱量得紅色固體質量為4.10g。
(1)操作A的名稱是
過濾
過濾
,在實驗室中完成操作A的玻璃儀器有玻璃棒、燒杯和漏斗
漏斗
;(2)檢驗反應后剩余紅色固體是否洗滌干凈的方法是:取少量最后一次洗滌液,加入
氫氧化鈉
氫氧化鈉
溶液,如果觀察到現象:無藍色沉淀生成
無藍色沉淀生成
,說明已洗滌干凈。(3)通過計算,假設3成立,紅色固體產物中Cu2O的含量為
1.44g
1.44g
;【方案二】稱取5.00g的紅色固體,用如下圖所示裝置進行實驗(固定裝置略去,堿石灰為氧化鈣和氫氧化鈉的混合物),通過測定反應前后裝置d的質量達到實驗目的。
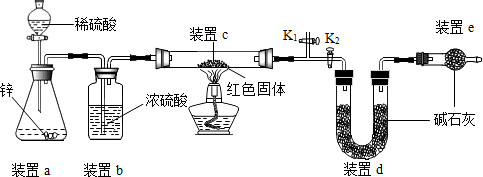
(1)裝置a中用稀硫酸而不用稀鹽酸,原因是
鹽酸揮發出氯化氫氣體,與d中的物質反應,影響測定結果
鹽酸揮發出氯化氫氣體,與d中的物質反應,影響測定結果
;(2)裝置b的作用是
干燥氫氣
干燥氫氣
,若不加裝置b,實驗結果會偏大
偏大
(“偏大”或“偏小”);(3)裝置c中涉及的反應(即:Cu2O和 H2反應生成Cu和 H2O)化學方程式
Cu2O+H2 2Cu+H2O
△
Cu2O+H2 2Cu+H2O
; △
(4)裝置e的作用是
防止空氣中CO2及H2O對裝置d的測量造成誤差
防止空氣中CO2及H2O對裝置d的測量造成誤差
,若不加裝置e,實驗結果會偏大
偏大
(“偏大”或“偏小”);(5)點燃酒精燈前涉及的部分操作如下,
①連接儀器;
②
檢查裝置的氣密性
檢查裝置的氣密性
;③關閉K2,打開K1,通氫氣一段時間以趕盡裝置內原有的空氣,其目的是:①防止空氣中的H2O和CO2進入裝置d干擾測定;②
氫氣不純,發生爆炸
氫氣不純,發生爆炸
。檢驗空氣是否趕盡的方法是:在K1處用小試管收集氣體,進行點燃
點燃
;④打開K2,關閉K1
(6)經測定反應前后裝置d的質量分別為100.00g、100.18g,計算產物中Cu2O的含量(寫出計算過程,最后結果保留小數點后1位);
【交流與反思】
(1)在方案一實驗測定中,若測定結果偏大,則下列可能的原因有
①、②
①、②
。(填序號)①反應后剩余紅色固體未洗滌干凈
②洗滌后未完全干燥
③干燥方法采用的是在空氣中加熱烘干
④稱量剩余紅色固體時,有部分固體灑落到實驗臺上
(2)方案二中利用同樣的裝置,還可通過測定反應前后裝置
c
c
(填“a”、“b”或“c”)的質量達到實驗目的。【答案】紅色固體Cu、Cu2O的混合物;部分;過濾;漏斗;氫氧化鈉;無藍色沉淀生成;1.44g;鹽酸揮發出氯化氫氣體,與d中的物質反應,影響測定結果;干燥氫氣;偏大;Cu2O+H2 2Cu+H2O;防止空氣中CO2及H2O對裝置d的測量造成誤差;偏大;檢查裝置的氣密性;氫氣不純,發生爆炸;點燃;①、②;c
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:35引用:3難度:0.4
相似題
-
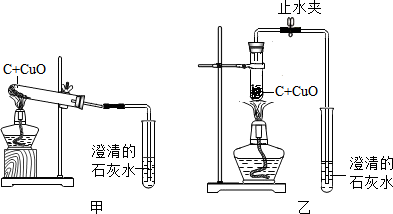
1.某化學興趣小組按照課本實驗方法(如圖甲),做木炭與氧化銅反應的實驗時,發現很難觀察到紫紅色銅的生成,卻往往有暗紅色固體出現.他們決定對這個實驗進行探究和改進.
【提出問題】暗紅色的固體是什么?如何選擇合適條件,使木炭還原氧化銅的實驗現象更
明顯?
【查閱資料】銅有+1 和+2 兩種化合價,通常情況下,氧的化合價為-2,碳的化合價為+4或-4.
【猜想與假設】
(1)同學們認為這種暗紅色固體可能是一種化合物,并猜測它的化學式為.
(2)同學們還認為,通過改變反應物的狀態、質量比,以及反應裝置,可以使該實驗現象
更加明顯,減少出現暗紅色固體的情況.
【分析與交流】
(1)小吳建議用超細炭粉與氧化銅粉末進行實驗.你認為這樣建議的原理是;
反應的化學方程式為.
(2)小周建議用圖乙裝置替代甲裝置.與甲相比較,乙裝置中將試管直立放置的好處是.
【實驗與結論】
同學們決定按改進后的方案進行實驗,他們在檢驗了乙后,往試管中加入已干燥的藥品并開始加熱,當看到澄清的石灰水剛出現渾濁時,
(填“可以”或“不能”)確定氧化銅和炭粉已經開始反應.不久,即可看到試管底部變紅熱,停止加熱后,仍能看到紅熱現象,并沿試管底部自下而上蔓延,這個現象說明該反應是(填“吸”或“放”)熱反應.待產物冷卻后,同學們終于找到了期待已久的紫紅色銅珠,實驗獲得了圓滿成功.發布:2024/11/15 8:0:2組卷:15引用:1難度:0.3 -
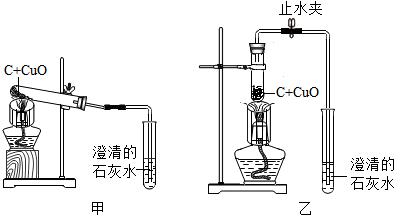
2.某化學興趣小組按照課本實驗方法(如圖甲),做木炭與氧化銅反應實驗時,發現很難觀察到紫紅色銅的生成,卻往往有暗紅色固體出現。他們決定對這個實驗進行探究和改進。
【提出問題】
暗紅色的固體是什么?如何選擇合適的條件,使木炭還原氧化銅的實驗現象更明顯?
【查閱資料】
銅有+1和+2兩種化合價,通常情況下,氧的化合價為-2,碳的化合價為+2或+4。
【猜想與假設】
(1)同學們認為這種暗紅色固體可能是一種化合物,它的化學式為。
(2)同學們還認為,通過改變反應物的狀態、質量比,以及反應裝置,可以使該實驗現象更加明顯,減少出現暗紅色固體的情況。
【分析與交流】
(3)小明同學建議用超細炭粉與氧化銅粉末進行實驗。原因是。
(4)對下列三種氧化銅和碳的質量比例,小芳建議選擇(填選項序號)的比例。
A.40:4 B.40:3 C.40:2
你認為小芳這樣選擇的理由是。
【實驗與結論】
(5)同學們決定按改進后的方案進行實驗,他們在檢驗了乙裝置的氣密性后,往試管中加入已干燥的藥品并開始加熱,當看到澄清的石灰水剛出現渾濁時,(填“能”或“不能”)確定氧化銅和炭粉已經開始反應。不久,即可看到試管底部變紅熱,停止加熱后,仍能看到紅熱現象,并沿試管底部自下而上蔓延,這個現象說明該反應是反應(填“吸熱”或“放熱”)。
(6)待反應結束,先將導氣管從石灰水中取出,然后關閉止水夾,讓產物自然冷卻。若不關閉止水夾,可能出現的問題是。待產物冷卻后,同學們終于找到了期待已久的紫紅色銅珠,實驗獲得了圓滿成功。發布:2024/11/15 8:0:2組卷:49引用:2難度:0.5 -
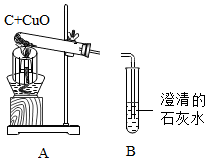 3.小強在實驗室完成木炭還原氧化銅的實驗。
3.小強在實驗室完成木炭還原氧化銅的實驗。
(1)以下為該實驗的步驟,正確的順序為(填序號)。
①將導管移出盛有石灰水的試管;②裝入藥品;③檢查裝置氣密性;④熄滅酒精燈;⑤固定裝置;⑥點燃酒精燈;⑦連接儀器。
(2)A裝置試管中觀察到的現象是。
(3)小剛認為A裝置(去掉網罩)也可用于實驗室以氯酸鉀和二氧化錳為原料制氧氣,原因是。發布:2024/11/27 8:0:1組卷:9引用:1難度:0.6


