根據(jù)要求,回答下列問題:
Ⅰ.把化學能轉化為電能的裝置叫做原電池。

(1)裝置①、②、③中,能組成原電池的是裝置 ②②。
(2)裝置④中,正極材料是 AgAg;負極的電極反應式為 Cu-2e-=Cu2+Cu-2e-=Cu2+;電池工作時,總反應的離子方程式為 Cu+2Ag+=2Ag+Cu2+Cu+2Ag+=2Ag+Cu2+;燒杯中NO-3向 CuCu電極移動(填“Cu”或“Ag”);導線中電子的流動方向為 Cu到AgCu到Ag (填“Cu到Ag”或“Ag到Cu”)。
Ⅱ.某同學利用鐵與鹽酸的反應,探究影響反應速率的因素(實驗所用鐵的質(zhì)量相等且鐵塊的形狀相同,鹽酸均過量),實驗設計如下:
NO
-
3
| 實驗編號 | 鹽酸濃度/(mol?L-1) | 鐵的狀態(tài) | 溫度/K |
| 1 | 2.00 | 塊狀 | 293 |
| 2 | 4.00 | 塊狀 | 293 |
| 3 | 4.00 | 粉末 | 293 |
| 4 | 4.00 | 塊狀 | 313 |
收集448mL氫氣所需的時間
收集448mL氫氣所需的時間
。(2)實驗1和2是探究
鹽酸的濃度
鹽酸的濃度
對該反應速率的影響。實驗 2
2
和 4
4
是探究溫度對該反應速率的影響。(3)不同時間t產(chǎn)生的氫氣體積V如圖甲所示,曲線c對應的實驗編號是
2
2
。每一組實驗中產(chǎn)生氫氣的速率v隨時間t變化的曲線如圖乙所示,其中t1~t2速率變化的主要原因是 鐵與鹽酸反應放熱,溫度升高使反應速率加快
鐵與鹽酸反應放熱,溫度升高使反應速率加快
。
(4)若上述實驗所用鹽酸的體積均為250mL,實驗3反應進行到2min時收集到448mL(標準狀況)氫氣,反應后溶液體積不變,則該條件下,該時間段內(nèi),以鹽酸的濃度變化表示的平均反應速率v(HCl)=
0.08mol?L-1?min-1
0.08mol?L-1?min-1
。【答案】②;Ag;Cu-2e-=Cu2+;Cu+2Ag+=2Ag+Cu2+;Cu;Cu到Ag;收集448mL氫氣所需的時間;鹽酸的濃度;2;4;2;鐵與鹽酸反應放熱,溫度升高使反應速率加快;0.08mol?L-1?min-1
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:28引用:2難度:0.6
相似題
-
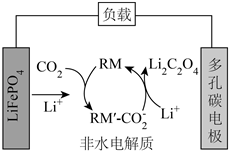 1.我國某科研團隊借助氧化還原介質(zhì)RM,將Li-CO2電池的放電電壓提高至3V以上,該電池的工作原理如圖。下列說法正確的是( )
1.我國某科研團隊借助氧化還原介質(zhì)RM,將Li-CO2電池的放電電壓提高至3V以上,該電池的工作原理如圖。下列說法正確的是( )A.LiFePO4電極的電勢比多孔碳電極的高 B.負極反應:LiFePO4-xe-═Li(1-x)FePO4+xLi+ C.RM和RM′- 均為該電池反應的催化劑CO-2D.LiFePO4電極每減重7g,就有22gCO2被固定 發(fā)布:2024/12/20 4:30:1組卷:156引用:2難度:0.5 -
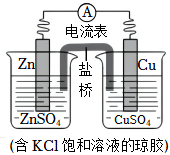 2.銅鋅原電池的裝置如圖,其中鹽橋為內(nèi)含KCl的瓊脂凝膠,下列說法不正確的是( )
2.銅鋅原電池的裝置如圖,其中鹽橋為內(nèi)含KCl的瓊脂凝膠,下列說法不正確的是( )A.Zn是負極反應物,發(fā)生氧化反應 B.電子從鋅片流向銅片 C.銅電極上發(fā)生反應Cu2++2e-═Cu D.鹽橋中Cl-進入CuSO4溶液 發(fā)布:2024/12/15 19:30:1組卷:194引用:1難度:0.5 -
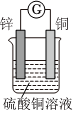 3.如圖所示將鋅、銅通過導線相連,置于硫酸銅溶液中。
3.如圖所示將鋅、銅通過導線相連,置于硫酸銅溶液中。
(1)該裝置將轉化為能。
(2)Zn電極為極,發(fā)生反應,電極方程式為。
(3)外電路電子由電極經(jīng)導線流向電極。
(4)若反應過程中鋅溶解了6.5g,則銅電極增重g,該回路中轉移的電子數(shù)為。發(fā)布:2024/12/30 3:0:4組卷:308引用:2難度:0.7


