“二氧化碳的實驗室制法”是九年級化學八個基礎實驗之一,某小組在老師的指導下進行了一系列探究實驗。請你一起參與他們的活動,并回答相關問題。
【探究活動一】:探究二氧化碳的制取過程
(1)選用藥品。
按如表進行實驗,取等質量的大理石加入足量酸中(雜質不與酸反應),產生二氧化碳體積隨時間變化曲線如圖1所示:
| 實驗編號 | 藥品 |
| Ⅰ | 塊狀大理石、10%鹽酸溶液 |
| Ⅱ | 塊狀大理石、10%硫酸溶液 |
| Ⅲ | 大理石粉末、10%鹽酸溶液 |
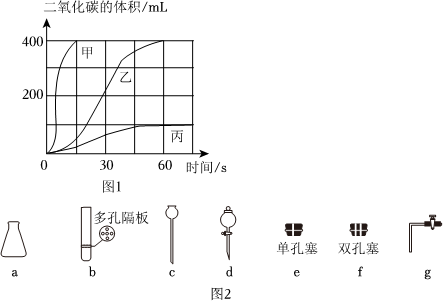
確定用乙對應的藥品制備二氧化碳,相應的化學方程式是
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
;不用甲對應的藥品,理由是 反應速率太快,不利于氣體的收集
反應速率太快,不利于氣體的收集
;圖中丙反應產生二氧化碳的量明顯偏小的原因可能是 產生的硫酸鈣覆蓋在大理石表面阻止反應進行,藥品沒有消耗完
產生的硫酸鈣覆蓋在大理石表面阻止反應進行,藥品沒有消耗完
。通過實驗Ⅰ、Ⅲ對比可得出結論 反應物接觸面積越大,反應越劇烈
反應物接觸面積越大,反應越劇烈
。(2)搭建裝置
如果組裝一套可控制反應發生和停止的裝置,應選用圖2中的
bcfg
bcfg
(選填編號)。【探究活動二】:探究能否用排水法收集二氧化碳
實驗一:同學們利用圖3裝置分別用排氣法和排水法收集一瓶二氧化碳。
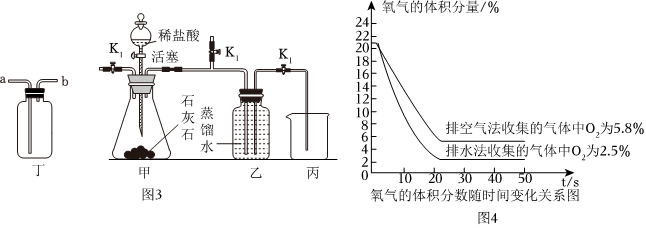
(3)實驗前需要先將甲裝置中的空氣排盡。其操作是:關閉彈簧夾K1和
K3
K3
;開啟彈簧夾 K2
K2
,打開活塞,滴加稀鹽酸至空氣排盡。檢驗空氣已排盡的方法是 在靠近K2口處放一個燃著的木條,若木條熄滅,則空氣已排盡
在靠近K2口處放一個燃著的木條,若木條熄滅,則空氣已排盡
。(4)將丁和甲相連,可以用排水法收集二氧化碳氣體,管口連接順序是c與
a
a
相連。排水法收集氣體:關閉K1、K2,打開K3,滴入稀鹽酸并開始計時,待水排盡用時28秒。
排氣法收集氣體:關閉K2、K3,打開K1,滴入稀鹽酸并開始計時,待空氣排盡用時15秒。
實驗二:用氧氣傳芯器分別測定排氣法和排水法收集的兩瓶CO,中O2的體積分數(圖4)。
【結論反思】
兩種方法收集CO2氣體中的氧氣均來自于空氣,如果以氧氣占空氣體積的
1
5
(5)兩種方法收集的氣體中二氧化碳體積分數的差值是
15.7%
15.7%
;(6)根據圖中數據判斷下列說法正確的是
CD
CD
(填字母)。A.排空氣法驗滿時,若瓶口木條熄滅,則瓶中二氧化碳體積分數為100%
B.圖中用排空氣法收集的氣體中二氧化碳的體積分數為94.2%
C.圖中用排水法收集的氣體中二氧化碳的體積分數為87.5%
D.從田中數據可推測二氧化碳從水里逸出的速度遠大于溶解在水里的速度
(7)根據上述實驗分析你認為
能
能
(填“能”或“不能”)用排水法收集二氧化碳。【考點】二氧化碳的實驗室制法;探究二氧化碳的性質.
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑;反應速率太快,不利于氣體的收集;產生的硫酸鈣覆蓋在大理石表面阻止反應進行,藥品沒有消耗完;反應物接觸面積越大,反應越劇烈;bcfg;K3;K2;在靠近K2口處放一個燃著的木條,若木條熄滅,則空氣已排盡;a;15.7%;CD;能
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/5 8:0:8組卷:60引用:1難度:0.5
相似題
-
1.實驗室制取氣體所需的裝置如圖所示,請回答以下問題。
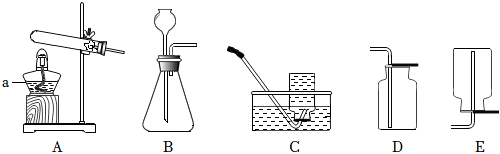
(1)a儀器名稱。收集氧氣可以選用C,原因是。用高錳酸鉀制氧氣,反應的化學方程式為。
(2)實驗室用石灰石和稀鹽酸制取CO2,發生裝置應選用,收集用,CO2的驗滿方法為。發布:2024/12/8 10:30:2組卷:50引用:4難度:0.5 -
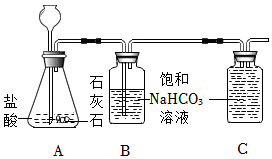 2.實驗室可用如圖裝置制取二氧化碳;已知常溫下CO2灘溶于飽和NaHCO3溶液。
2.實驗室可用如圖裝置制取二氧化碳;已知常溫下CO2灘溶于飽和NaHCO3溶液。
(1)寫出A裝置中發生反應的化學方程式。
(2)B中飽和碳酸氫鈉溶液的作用是什么?
(3)利用排飽和NaHCO3溶液法可以收集較純凈的二氧化碳氣體,請將C裝置中的導管補畫完整。發布:2024/12/25 15:0:2組卷:7引用:2難度:0.6 -
3.用圖-1所示裝置制取干燥的CO2,并對CO2的部分性質進行探究。
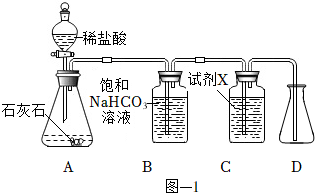
(1)裝置A中發生反應的化學方程式為。
(2)①裝置B中飽和NaHCO3溶液的作用是。
②裝置C中試劑X應該選用(填字母)。
a.稀H2SO4
b.濃H2SO4
c.KOH溶液
(3)收集CO2并驗滿。將集滿CO2的錐形瓶與盛有足量NaOH溶液的注射器和傳感器密封連接,緩慢的將NaOH溶液注入到錐形瓶中,采集信息形成圖像。見圖-2。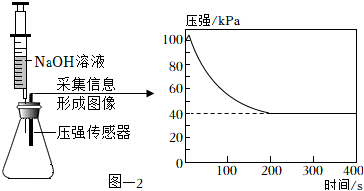
①檢驗裝置D中CO2已經集滿的方法是。
②隨著反應的進行,錐形瓶中壓強降低的原因是。
③反應結束后錐形瓶中的壓強保持在40kPa說明。
(4)取2mL飽和澄清石灰水于試管中,用4mL蒸餾水稀釋,向其中緩慢通入足量CO2。測定反應體系的電導率變化如圖-3所示。(忽略反應前后溶液體積的變化)
【查閱資料】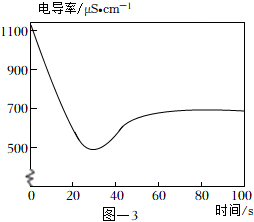
材料一:溶液的導電能力越強,溶液的電導率越大。
材料二:單位體積溶液中某離子的個數越多,則該離子的濃度越大,溶液的導電能力越強。相同濃度的不同離子導電能力不同。
材料三:Ca( OH)2溶于水能完全解離出Ca2+和OH-。
CaCO3遇到溶有CO2的水時,能反應生成易溶于水的Ca( HCO3)2,Ca( HCO3)2在水中能完全解離出Ca2+和。HCO-3
①石灰水中通入CO2氣體,溶液的電導率先逐漸降低的主要原因是。
②反應最終電導率的穩定值低于初始值的可能原因是、。發布:2024/12/25 13:0:1組卷:834引用:3難度:0.6


