自舍勒發現氯氣可以作為消毒劑以來,人們陸續發現和使用了形形色色的消毒劑。
(1)舍勒發現氯氣的方法至今還是實驗室制取氯氣的主要方法之一。請寫出實驗室用MnO2和濃鹽酸制氯氣的化學反應方程式,并用雙線橋表示電子的轉移 
 。反應中鹽酸表現出的性質有 酸性和還原性酸性和還原性。
。反應中鹽酸表現出的性質有 酸性和還原性酸性和還原性。
(2)根據世界環保聯盟的要求,二氧化氯(ClO2)消毒劑將逐漸取代Cl2成為水的消毒劑。工業上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后制得ClO2,反應的離子方程式為:22ClO-3+11SO2-3+22H+H+=22ClO2+11SO2-4+11H2O。
(3)高鐵酸鉀K2FeO4是新型高效、多功能、綠色消毒劑。
①濕法制備高鐵酸鉀的反應體系中有六種微粒:Fe(OH)3、Cl-、OH-、FeO2-4、ClO-、H2O,寫出濕法制備高鐵酸鉀的離子方程式 2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O。
②如圖所示,用Cl2氧化Fe(OH)3也可以制備高鐵酸鉀,反應原理為:3Cl2+2Fe(OH)3+10OH-=2FeO2-4+6Cl-+8H2O。
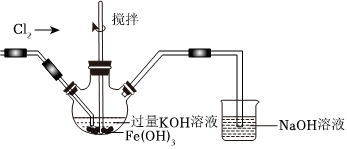
反應后取出三口瓶中的溶液于試管中,加入稀H2SO4后產生黃綠色氣體Cl2,同時檢測到溶液中存在Fe3+。制備高鐵酸鉀的實驗中,氧化性:Cl2>>K2FeO4(填寫>,<或=)。試管中發生反應再次產生Cl2的實驗中,氧化性:Cl2<<K2FeO4(填寫>,<或=)。試說明影響Cl2和K2FeO4氧化性強弱的因素 溶液的酸堿性溶液的酸堿性。


C
l
O
-
3
SO
2
-
3
SO
2
-
4
F
e
O
2
-
4
F
e
O
2
-
4
【答案】 ;酸性和還原性;2;1;2;H+;2;1;1;2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O;>;<;溶液的酸堿性
;酸性和還原性;2;1;2;H+;2;1;1;2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O;>;<;溶液的酸堿性
 ;酸性和還原性;2;1;2;H+;2;1;1;2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O;>;<;溶液的酸堿性
;酸性和還原性;2;1;2;H+;2;1;1;2Fe(OH)3+3ClO?+4OH?=2FeO42?+3Cl?+5H2O;>;<;溶液的酸堿性【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:32引用:1難度:0.8
相似題
-
1.根據下列兩個反應判斷:2Cu+O2=2CuO,2Cu+S=Cu2S,下列敘述中錯誤的是( )
A.硫和氧氣反應中作氧化劑 B.氧氣的氧化性比硫強 C.硫的氧化性比氧氣強 D.銅是一種具有可變化合價的元素 發布:2024/12/30 14:30:1組卷:16引用:2難度:0.9 -
2.實驗證明,在一定溫度和壓強下,用銅的化合物做催化劑,甲烷(CH4)與氧氣反應只生成甲醇(CH3OH)。下列敘述正確的是( )
A.甲烷是有機物,甲醇是氧化物 B.該反應及時氧化還原反應又是化合反應 C.該反應中甲醇是還原產物,甲烷是氧化劑 D.該反應的化學方程式為CH4+O2═CH3OH 發布:2025/1/7 8:0:2組卷:2引用:1難度:0.7 -
3.將適量的SO2通入Fe(NO3)3溶液中,溶液逐漸由棕黃色變為淺綠色,但又立即變為棕黃色,繼續滴入BaCl2溶液,產生白色沉淀。在上述一系列變化過程中,最終被還原的元素是( )
A.氮 B.硫 C.鐵 D.氧 發布:2024/12/30 14:30:1組卷:27引用:2難度:0.6


