2022-2023學年北京十二中高一(上)期中化學試卷
發布:2024/12/16 9:0:2
一、選擇題(每小題只有一個選項符合題意,每小題2分,共40分)
-
1.下列文物修復和保護的過程中涉及化學變化的是( )
A B C D 



銀器用除銹劑見新 變形的金屬香爐復原 古畫水洗除塵 木器表面擦拭燙蠟 A.A B.B C.C D.D 組卷:4引用:3難度:0.8 -
2.CaO、Na2O、Fe2O3、CuO均屬于氧化物,下列物質都能與它們發生反應的是( )
A.水 B.鹽酸 C.NaOH溶液 D.O2 組卷:7引用:1難度:0.6 -
3.我國科學家將地球科學引入納米材料的研究,一項關于粒子直徑在3~10nm的納米金屬的研究成果刊登上《Nature》。若將納米金屬銅分散在水中形成分散系,關于該分散系的說法中不正確的是( )
A.納米金屬銅在分散系中做布朗運動 B.光束通過該分散系時會形成一條光亮的“通路” C.在外加電場作用下,納米金屬銅可能向某一電極做定向運動 D.用過濾的方法可將納米金屬銅從分散系中分離出來 組卷:13引用:1難度:0.6 -
4.在化學實驗中,具有安全意識是重要的科學素養。下列實驗操作不正確的是( )
A.氫氣點燃前,先檢驗氫氣的純度 B.金屬鈉著火時,用干燥的沙土覆蓋 C.稀釋濃硫酸時,將水沿燒杯內壁倒入濃硫酸中 D.聞氯氣時,用手在瓶口輕輕扇動,使極少量的氯氣飄進鼻孔 組卷:27引用:6難度:0.6 -
5.下列關于物質分類的組合正確的是( )
堿性氧化物 堿 鹽 A 氧化鈉 純堿 硫酸鈉 B 生石灰 苛性鈉 石灰石 C 熟石灰 小蘇打 氯化鎂 D 過氧化氫 氫氧化鉀 高錳酸鉀 A.A B.B C.C D.D 組卷:21引用:1難度:0.6 -
6.NA是阿伏加德羅常數的值。下列說法中正確的是( )
A.常溫常壓下,2.24LN2中含有0.2molN B.0.5mol?L-1的Na2SO4溶液中含有的Na+數目為NA C.欲配制500mL0.1mol/LHCl溶液,需溶解標準狀況下HCl氣體1.12L D.在標準狀況下,20mLNH3和60mLO2所含原子個數比為1:3 組卷:22引用:1難度:0.6 -
7.下列各項比較中,一定相等的是( )
A.相同物質的量的Fe分別與足量的O2、Cl2充分反應轉移的電子數目 B.相同質量的CH4和C2H4所含氫原子數目 C.相同質量的Na分別完全轉化為Na2O和Na2O2時轉移的電子的數目 D.相同物質的量濃度的NaCl溶液和MgCl2溶液中c(Cl-) 組卷:16引用:1難度:0.5 -
8.下列敘述中,正確的是( )
A.KNO3固體不導電,所以KNO3不是電解質 B.銅絲、石墨均能導電,但它們都不是電解質 C.熔融的HCl能導電,所以HCl是電解質 D.NaCl溶于水,在通電條件下才能發生電離 組卷:68引用:3難度:0.6
二、第二部分非選擇題(共60分)
-
24.自舍勒發現氯氣可以作為消毒劑以來,人們陸續發現和使用了形形色色的消毒劑。
(1)舍勒發現氯氣的方法至今還是實驗室制取氯氣的主要方法之一。請寫出實驗室用MnO2和濃鹽酸制氯氣的化學反應方程式,并用雙線橋表示電子的轉移。反應中鹽酸表現出的性質有。
(2)根據世界環保聯盟的要求,二氧化氯(ClO2)消毒劑將逐漸取代Cl2成為水的消毒劑。工業上常用NaClO3和Na2SO3溶液混合并加入稀H2SO4酸化后制得ClO2,反應的離子方程式為:+ClO-3+SO2-3=ClO2++SO2-4H2O。
(3)高鐵酸鉀K2FeO4是新型高效、多功能、綠色消毒劑。
①濕法制備高鐵酸鉀的反應體系中有六種微粒:Fe(OH)3、Cl-、OH-、、ClO-、H2O,寫出濕法制備高鐵酸鉀的離子方程式FeO2-4。
②如圖所示,用Cl2氧化Fe(OH)3也可以制備高鐵酸鉀,反應原理為:3Cl2+2Fe(OH)3+10OH-=2+6Cl-+8H2O。FeO2-4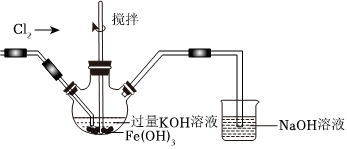
反應后取出三口瓶中的溶液于試管中,加入稀H2SO4后產生黃綠色氣體Cl2,同時檢測到溶液中存在Fe3+。制備高鐵酸鉀的實驗中,氧化性:Cl2K2FeO4(填寫>,<或=)。試管中發生反應再次產生Cl2的實驗中,氧化性:Cl2K2FeO4(填寫>,<或=)。試說明影響Cl2和K2FeO4氧化性強弱的因素。組卷:32引用:1難度:0.8 -
25.某小組研究Na2S溶液與KMnO4溶液反應,探究過程如下。
資料:ⅰ.實驗序號 Ⅰ Ⅱ 實驗過程 

實驗現象 紫色變淺(pH<1),生成棕褐色沉淀(MnO2) 溶液呈淡黃色(pH≈8),生成淺粉色沉淀(MnS) 在強酸性條件下被還原為Mn2+,在近中性條件下被還原為MnO2。MnO-4
ⅱ.單質硫可溶于硫化鈉溶液,溶液呈淡黃色。
(1)根據實驗可知,Na2S具有性。
(2)甲同學預測實驗Ⅰ中S2-被氧化成。SO2-3
①根據實驗現象,乙同學認為甲的預測不合理,理由是。
②乙同學取實驗Ⅰ中少量溶液進行實驗,檢測到有,得出S2-被氧化成SO2-4的結論,丙同學否定了該結論,理由是SO2-4。
③同學們經討論后,設計了如下實驗,證實該條件下的確可以將S2-氧化成MN-4.SO2-4
a.右側燒杯中的溶液是。
b.連通后電流計指針偏轉,一段時間后,(填操作和現象)。
(3)實驗Ⅰ的現象與資料i存在差異,其原因是新生成的產物(Mn2+)與過量的反應物()發生反應,該反應的離子方程式是MN-4。
(4)實驗Ⅱ的現象與資料也不完全相符,丁同學猜想其原因與(3)相似,經驗證猜想成立,他的實驗方案是。
(5)反思該實驗,反應物相同,而現象不同,體現了物質變化不僅與其自身的性質有關,還與因素有關。組卷:76引用:7難度:0.4


