化學小組同學為探究新制氯水的成分及性質進行了如下實驗:
【資料】I2遇到淀粉溶液變藍,常用于檢驗碘的存在。
| 實驗① | 實驗② | 實驗③ | 實驗④ | 實驗⑤ | |
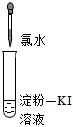
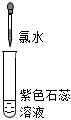
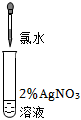
| 實驗操作 (試管中溶液均為1mL,均滴入5滴氯水) |
 |
 |
 |
|
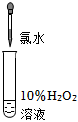 |
| 實驗現象 | 蒸餾水由無色逐漸變為淺黃綠色 | 溶液變藍 | 石蕊溶液先變紅,后褪色 | 產生白色沉淀 | 產生大量無色氣泡 |
>
>
I2(填“>”或“<”)。(2)證明氯水中含有Cl-的是實驗
④
④
(填序號),用離子方程式表示該實驗中涉及的反應 Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
、Cl-+Ag+=AgCl
Cl-+Ag+=AgCl
。(3)實驗③中溶液變紅是由于溶液中含有
H+(或HCl)
H+(或HCl)
(填微粒符號,下同);使溶液褪色的微粒是 HClO
HClO
。(4)同學們根據“H2O2在催化劑作用下可發生分解”的性質,認為實驗⑤中現象不能說明氧化性Cl2>H2O2。為證實Cl2將H2O2氧化,可繼續補充實驗:
反應后向溶液中加入1mL 2%AgNO3溶液,產生的沉淀量明顯大于實驗④
反應后向溶液中加入1mL 2%AgNO3溶液,產生的沉淀量明顯大于實驗④
(填操作、現象)。(5)同學們發現久置的氯水會失去漂白性,溶液由黃綠色變為無色。為探究氯水失效的原因,進行實驗:用強光照射盛有氯水的密閉廣口瓶,并用傳感器測定廣口瓶中數據,得到如圖曲線。
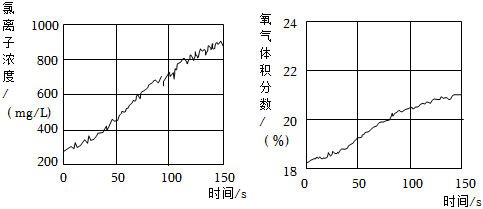
解釋如兩圖中曲線變化的原因
由于HClO不穩定,見光受熱易分解,2HClO 2HCl+O2↑,使O2體積分數增加,Cl2與水不斷反應和HClO分解生成的HCl使溶液中c(Cl-)增大
光照
由于HClO不穩定,見光受熱易分解,2HClO 2HCl+O2↑,使O2體積分數增加,Cl2與水不斷反應和HClO分解生成的HCl使溶液中c(Cl-)增大
。若在上述整個實驗過程中測定溶液的pH,pH的變化是 光照
逐漸減小(最終不變)
逐漸減小(最終不變)
。【考點】氯、溴、碘的性質實驗;氯氣的化學性質.
【答案】>;④;Cl2+H2O=H++Cl-+HClO;Cl-+Ag+=AgCl;H+(或HCl);HClO;反應后向溶液中加入1mL 2%AgNO3溶液,產生的沉淀量明顯大于實驗④;由于HClO不穩定,見光受熱易分解,2HClO 2HCl+O2↑,使O2體積分數增加,Cl2與水不斷反應和HClO分解生成的HCl使溶液中c(Cl-)增大;逐漸減小(最終不變)
光照
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:66引用:3難度:0.7
相似題
-
1.請用下列裝置設計一個實驗,證明Cl2的氧化性比I2的氧化性強.

請回答下列問題:
(1)若氣流從左到右,則上述儀器的連接順序為D接E,接,接.
(2)圓底燒瓶中發生反應的化學方程式為.
(3)證明Cl2比I2的氧化性強的實驗現象是,反應的離子方程式是.
(4)裝置②的作用是.
(5)若要證明Cl2的氧化性比Br2強,則需做的改動是.發布:2024/6/27 10:35:59組卷:109引用:4難度:0.3 -
2.為了探究HClO的漂白性,某同學設計了如圖所示的實驗:

(1)通入Cl2后,從集氣瓶A中干燥的紅色布條的現象可得出的結論是.
(2)從集氣瓶B中濕潤的紅色布條的現象可得出的結論是,其中發生反應的化學方程式是.
(3)為了確證是HClO起漂白作用,你認為還應增加的實驗是.
(4)燒杯中發生反應的化學方程式是.發布:2024/6/27 10:35:59組卷:43引用:3難度:0.7 -
3.某同學設計了一套實驗裝置來電解飽和食鹽水,并檢驗氯氣的氧化性和測定所產生的氫氣的體積(約8mL)。

(1)試從如圖中選用幾種必要的儀器,連成一整套裝置,各種儀器接口的連接順序(填編號)是:A接,接;B接,接;
(2)鐵棒接直流電源的極;碳棒上發生的電極反應為;
(3)能說明氯氣具有氧化性的實驗現象是;
(4)寫出氯氣通入NaOH溶液的離子方程式;
(5)若裝入的飽和食鹽水為75mL前后溶液體積變化可忽略,假設兩極產生的氣體全部逸出),當測得氫氣為8.4mL(標準狀況)時停止通電。將U形管內的溶液倒入燒杯,其pH約為。發布:2024/6/27 10:35:59組卷:25引用:1難度:0.6


