CO和NO是汽車尾氣中的主要污染物,易引起酸雨、溫室效應和光化學煙霧等環(huán)境污染問題。隨著我國機動車保有量的飛速發(fā)展,汽車尾氣的有效處理變得迫在眉睫。其中的一種方法為2CO(g)+2NO(g)=N2(g)+2CO2(g),請回答下列問題:
(1)已知該反應為自發(fā)反應,則該反應的反應熱△H <<0(填“>”或“<”或“=”)
(2)已知:N2(g)+O2(g)═2NO(g)△H=akJ?mol-1
C(s)+O2(g)═CO2(g)△H=bkJ?mol-1
2C(s)+O2(g)═2CO(g)△H=ckJ?mol-1
則2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=2b-a-c2b-a-ckJ?mol-1(用含a、b、c的表達式表示)。
(3)一定溫度下,將2molCO、4molNO充入一恒容密閉容器。已知起始壓強為1MPa,到達平衡時,測得N2的物質的量為0.5mol,則:
①該溫度此反應用平衡分壓代替平衡濃度的平衡常數(shù)Kp=(0.55.5×5.56MPa)×(15.5×5.56MPa)2(15.5×5.56MPa)2×(35.5×5.56MPa)2(0.55.5×5.56MPa)×(15.5×5.56MPa)2(15.5×5.56MPa)2×(35.5×5.56MPa)2。(寫出計算表示式)
②該條件下,可判斷此反應到達平衡的標志是 BB。
A.單位時間內,斷裂2molC=O同時形成1molN≡N。
B.混合氣體的平均相對分子質量不再改變。
C.混合氣體的密度不再改變。
D.CO與NO的轉化率比值不再改變。
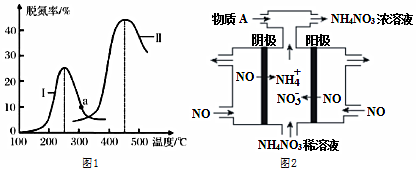
(4)某研究小組探究催化劑對CO、NO轉化的影響。將CO和NO以一定的流速通過兩種不同的催化劑進行反應,相同時間內測量逸出氣體中N2的含量,從而確定尾氣脫氮率(即NO的轉化率),結果如圖1所示:
①由圖可知:要達到最大脫氮率,該反應應采取的最佳實驗條件為 催化劑Ⅱ,450℃催化劑Ⅱ,450℃。
②若低于200℃,圖中曲線I脫氮率隨溫度升高變化不大的主要原因為 低溫時,催化劑的活性偏低低溫時,催化劑的活性偏低。
(5)電解NO制備NH4NO3,其工作原理如圖2所示,為使電解產物全部轉化為NH4NO3,需要補充物質A,A是 NH3NH3,理由是 電池總反應為:8NO+7H2O=3NH4NO3+2HNO3,電解產生的硝酸多,故應補充氨氣電池總反應為:8NO+7H2O=3NH4NO3+2HNO3,電解產生的硝酸多,故應補充氨氣。
(
0
.
5
5
.
5
×
5
.
5
6
MP
a
)
×
(
1
5
.
5
×
5
.
5
6
MP
a
)
2
(
1
5
.
5
×
5
.
5
6
MP
a
)
2
×
(
3
5
.
5
×
5
.
5
6
MP
a
)
2
(
0
.
5
5
.
5
×
5
.
5
6
MP
a
)
×
(
1
5
.
5
×
5
.
5
6
MP
a
)
2
(
1
5
.
5
×
5
.
5
6
MP
a
)
2
×
(
3
5
.
5
×
5
.
5
6
MP
a
)
2
【答案】<;2b-a-c;;B;催化劑Ⅱ,450℃;低溫時,催化劑的活性偏低;NH3;電池總反應為:8NO+7H2O=3NH4NO3+2HNO3,電解產生的硝酸多,故應補充氨氣
(
0
.
5
5
.
5
×
5
.
5
6
MP
a
)
×
(
1
5
.
5
×
5
.
5
6
MP
a
)
2
(
1
5
.
5
×
5
.
5
6
MP
a
)
2
×
(
3
5
.
5
×
5
.
5
6
MP
a
)
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:56引用:2難度:0.5
相似題
-
1.升高溫度,下列數(shù)據(jù)不一定增大的是( )
A.化學反應速率v B.水的離子積常數(shù)Kw C.化學平衡常數(shù)K D.氨水的電離平衡常數(shù)Ka 發(fā)布:2025/1/6 6:0:5組卷:31引用:4難度:0.7 -
2.催化還原CO2是解決溫室效應及能源問題的重要手段之一。研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發(fā)生以下兩個平衡反應。下列有關說法不正確的是( )
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ?mol-1A.反應①為放熱反應,反應②為吸熱反應 B.使用不同催化劑,會改變反應①②的△H C.反應CO(g)+2H2(g)?CH3OH(g)的△H3=-94.9kJ?mol-1 D.投料比不變,增加反應物的濃度可提高CO2轉化為CH3OH平衡轉化率 發(fā)布:2025/1/6 6:0:5組卷:90引用:3難度:0.5 -
3.現(xiàn)代工業(yè)將煤汽化,既可以提高燃料的利用率、減少CO、SO2等的排放,又可以擴大水煤氣的用途.甲醇是一種可再生能源,具有開發(fā)和應用的廣闊前景,工業(yè)上一般可采用水煤氣來合成甲醇CO(g)+2H2(g)?CH3OH(g).
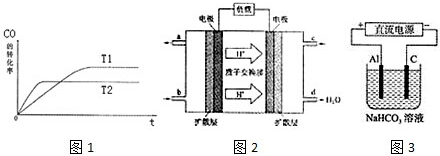
(1)如圖1是該反應在不同溫度下CO的轉化率隨時間變化的曲線.
①T1和T2溫度下的平衡常數(shù)大小關系是K1K2(填“>”、“<”或“=”).
②以下有關說法正確的是
a.恒溫、恒容條件下,容器內的壓強不發(fā)生變化則可逆反應達到平衡
b.一定條件下,H2的消耗速率是CO的消耗速率的2倍時可逆反應達到平衡
c.使用合適的催化劑能縮短達到平衡的時間并提高CH3OH的產率
d.某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2mol/L,則CO的轉化率為80%
(2)已知在常溫常壓下①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-bkJ?mol-1③H2O(g)=H2O(1)△H=-ckJ?mol-1
則:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=kJ?mol-1
(3)2009年10月,中國科學院長春應用化學研究所在甲醇燃料電池技術方面獲得新突破,組裝出了自呼吸電池及主動式電堆.甲醇燃料電池的工作原理如圖2所示.
①該電池正極的電極反應式為.
②工作一段時間后,當6.4g甲醇完全反應生成CO2時,有個電子發(fā)生轉移.
(4)以上述電池做電源,用圖3所示裝置,在實驗室中模擬鋁制品面“鈍化”處理的過程中,發(fā)現(xiàn)溶液逐漸變渾濁,原因是、(用相關的電極反應式和離子方程式表示)發(fā)布:2024/12/30 14:0:1組卷:26引用:3難度:0.5


