當前位置:
試題詳情
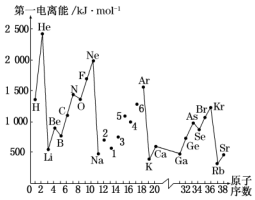 第一電離能I1是指氣態(tài)原子X(g)失去一個電子成為氣態(tài)陽離子X+(g)所需的能量.圖是部分元素原子的第一電離能I1隨原子序數(shù)變化的曲線圖.
第一電離能I1是指氣態(tài)原子X(g)失去一個電子成為氣態(tài)陽離子X+(g)所需的能量.圖是部分元素原子的第一電離能I1隨原子序數(shù)變化的曲線圖.
請回答以下問題:
(1)從圖分析可知,同一主族元素原子的第一電離能I1的變化規(guī)律是 上到下依次減小上到下依次減小.
(2)圖中5號元素在周期表中的位置是 第三周期第三周期、ⅤA族ⅤA族.
(3)圖中4、5、6三種元素的氣態(tài)氫化物的沸點均比同主族上一周期的元素氣態(tài)氫化物低很多,原因是:
NH3、H2O、HF分子內存在氫鍵,所以氣態(tài)氫化物的熔沸點高NH3、H2O、HF分子內存在氫鍵,所以氣態(tài)氫化物的熔沸點高.
(4)氣態(tài)鋰原子失去核外不同電子所需的能量分別為:失去第一電子為519kJ?mol-1,失去第二個電子為7296kJ?mol-1,失去第三個電子為11 799kJ?mol-1,由此數(shù)據分析為何鋰原子失去核外第二個電子時所需的能量要遠遠大于失去第一個電子所需的能量 鋰原子失去一個電子后,Li+已形成穩(wěn)定結構,此時再失去電子很困難鋰原子失去一個電子后,Li+已形成穩(wěn)定結構,此時再失去電子很困難.
【考點】元素電離能、電負性的含義及應用.
【答案】上到下依次減小;第三周期;ⅤA族;NH3、H2O、HF分子內存在氫鍵,所以氣態(tài)氫化物的熔沸點高;鋰原子失去一個電子后,Li+已形成穩(wěn)定結構,此時再失去電子很困難
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網所有,未經書面同意,不得復制發(fā)布。
發(fā)布:2024/12/30 18:30:1組卷:6引用:3難度:0.5
相似題
-
1.已知Al、Mg、Na為第三周期元素,其原子的第一至第四電離能如下表:
(1)則Al、Mg、Na的電負性從大到小的順序為電離能/kJ?mol-1 I1 I2 I3 I4 X 578 1817 2745 11578 Y 738 1451 7733 10540 Z 496 4562 6912 9543 ;
(2)C、N、O、H是周期表中前10號元素,它們的原子半徑依次減小,H能分別與C、N、O形成電子總數(shù)相等的分子CH4、NH3、H2O。
①在CH4、NH3、H2O分子中,C、N、O三原子都采取雜化;
②CH4是含有鍵(填“極性”或“非極性”)的分子(填“極性”或“非極性”);
③NH3是一種易液化的氣體,請簡述其易液化的原因;
④H2O分子的VSEPR模型的空間構型為,H2O分子的空間構型為;
(3)K、Cr、Cu三種元素的原子序數(shù)依次增大,三原子的核外的最外層電子排布均為4s1。
①K元素組成的單質的晶體堆積模型為(填代號);
a.簡單立方堆積
b.體心立方堆積
c.六方最密堆積
d.面心立方最密堆積
②Cr元素在其化合物中最高化合價為;
③Cu2+離子的核外電子排布式為。發(fā)布:2025/1/5 8:0:1組卷:3引用:1難度:0.7 -
 2.我國在青藏高原發(fā)現(xiàn)大儲量可燃冰.可燃冰的晶體結構模型如圖:
2.我國在青藏高原發(fā)現(xiàn)大儲量可燃冰.可燃冰的晶體結構模型如圖:
(1)C、N、O三種元素第一電離能由大到小的排列順序是>>(填元素符號),H2O分子中O原子的雜化方式為.
(2)“可燃冰”晶體內部存在的作用力有.
(3)下列有關“可燃冰”的說法中,不正確的是.
A.“可燃冰”的存在說明甲烷易溶于水
B.“可燃冰”屬于分子晶體,熔點較低
C.相同條件下,“可燃冰”的密度比冰的大
D.“可燃冰”只能在低溫、高壓環(huán)境下穩(wěn)定存在
(4)晶體中平均每46個水分子構成8個籠,每個籠可容納1個CH4分子或1個H2O分子,每8個籠中有6個容納CH4分子,2個籠填充H2O分子,則“可燃冰”(天然氣水合物)的平均組成可表示為.發(fā)布:2024/12/31 8:0:1組卷:23引用:1難度:0.3 -
3.鐵及其化合物在生產生活及科學研究方面應用非常廣泛。
(1)基態(tài)Fe原子的價層電子的電子排布圖為,其最外層電子的電子云形狀為。
(2)(NH4)2Fe(SO4)2?6H2O俗稱摩爾鹽。
①O、S兩元素的電負性由大到小的順序為(用元素符號表示)。
②N、O兩元素的第一電離能由大到小的順序為(用元素符號表示)。
③SO42-中S原子的雜化方式為,VSEPR模型名稱為。
(3)Fe3+可與某陰離子發(fā)生特征的顯色反應,用于鑒定Fe3+.該陰離子的電子式為,σ鍵和π鍵的數(shù)目之比為。其空間構型為。
(4)K3[Fe(CN)6]晶體中配離子的配位體為(用化學符號表示)發(fā)布:2025/1/5 8:0:1組卷:19引用:1難度:0.6


