鐵的腐蝕與防護與生產生活密切相關。
Ⅰ.研究鐵的腐蝕
實驗步驟如下:
步驟1:將鐵粉放置于0.002mol/LCuSO4溶液中浸泡,過濾后用水洗滌
步驟2:向15.00mL1mol/LNaCl溶液(用鹽酸調pH=1.78)中加入浸泡過的Fe粉
步驟3:采集溶液pH隨時間變化的數據。
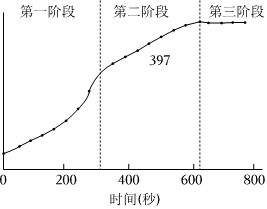
(1)第一階段,主要發生析氫腐蝕,Cu上發生的電極反應為 2H++2e-=H2↑2H++2e-=H2↑。
(2)第二、三階段主要發生吸氧腐蝕
①選取b點進行分析:經檢驗溶液中含有Fe2+,寫出Fe被腐蝕的總反應 2Fe+O2+4H+=2Fe2++2H2O2Fe+O2+4H+=2Fe2++2H2O。
②取b點溶液向其中滴加KSCN無明顯現象,加入稀鹽酸后立即變紅。b點Fe2+被氧化的離子方程式為 4Fe2++O2+4H+=4Fe3++2H2O4Fe2++O2+4H+=4Fe3++2H2O。
③依據b點發生的反應,分析第二階段pH升高的原因是 相同時間內,鐵被氧化為Fe2+消耗H+的量大于Fe2+被氧化為產生H+的量相同時間內,鐵被氧化為Fe2+消耗H+的量大于Fe2+被氧化為產生H+的量。
Ⅱ.研究鐵的防護
(3)在鐵表面鍍鋅可有效防止鐵被腐蝕
已知:Zn2+放電的速率緩慢且平穩,有利于得到致密、細膩的鍍層。
①鍍件Fe應與電源的 負極負極相連。
②向ZnSO4電解液中加入NaCN溶液,將Zn2+轉化為[Zn(CN)4]2-,電解得到的鍍層更加致密、細膩,原因是 通過反應Zn2++4CN-=[Zn(CN)4]2-,降低了c(Zn2+),使得Zn2+放電速率減慢,同時通過平衡的移動補充放電消耗的Zn2+,使其濃度保持相對穩定,達到放電速率平穩的作用通過反應Zn2++4CN-=[Zn(CN)4]2-,降低了c(Zn2+),使得Zn2+放電速率減慢,同時通過平衡的移動補充放電消耗的Zn2+,使其濃度保持相對穩定,達到放電速率平穩的作用。
(4)電鍍后的廢水中通常含有CN-,用如圖所示裝置除去含CN-、Cl-廢水中的CN-時,控制溶液pH為9~10,陽極產生的ClO-將CN-氧化為兩種無污染的氣體,下列說法正確的是 ABCABC。
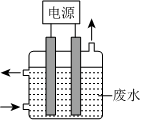
A.用石墨作陽極,鐵作陰極
B.陽極的電極反應式為:Cl-+2OH--2e-═ClO-+H2O
C.陰極的電極反應式為:2H2O+2e-═H2↑+2OH-
D.除去CN-的反應:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O
【答案】2H++2e-=H2↑;2Fe+O2+4H+=2Fe2++2H2O;4Fe2++O2+4H+=4Fe3++2H2O;相同時間內,鐵被氧化為Fe2+消耗H+的量大于Fe2+被氧化為產生H+的量;負極;通過反應Zn2++4CN-=[Zn(CN)4]2-,降低了c(Zn2+),使得Zn2+放電速率減慢,同時通過平衡的移動補充放電消耗的Zn2+,使其濃度保持相對穩定,達到放電速率平穩的作用;ABC
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/10/12 10:0:1組卷:27引用:1難度:0.6
相似題
-
1.用如圖裝置進行鐵的電化學腐蝕實驗。下列說法正確的是( )一段時間后,左側試管發熱,導管口有氣泡產生。
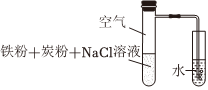
A.鐵發生的電極反應:Fe-3e-═Fe3+ B.鐵腐蝕過程中,化學能轉化為熱能 C.炭粉的存在對鐵腐蝕的速率無影響 D.導管口產生氣泡證明鐵發生了析氫腐蝕 發布:2024/12/12 1:30:1組卷:78引用:2難度:0.7 -
2.下列敘述與電化學腐蝕有關的是( )
A.炒過菜的鐵鍋不及時清洗易生銹 B.在空氣中金屬鎂具有較好的抗腐蝕性 C.紅熱的鐵絲與水接觸時,表面形成了藍黑色的物質 D.把鐵片投入到氯化銅溶液中,在鐵表面上附著一層紅色的銅 發布:2025/1/6 6:0:5組卷:4引用:3難度:0.7 -
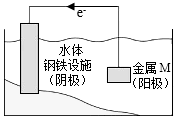 3.將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在如圖所示的情境中,下列有關說法正確的是( )
3.將金屬M連接在鋼鐵設施表面,可減緩水體中鋼鐵設施的腐蝕。在如圖所示的情境中,下列有關說法正確的是( )A.鋼鐵設施表面因積累大量電子而被保護 B.金屬M的活動性比Fe的活動性弱 C.陰極的電極反應式為Fe-2e-=Fe2+ D.鋼鐵設施在河水中的腐蝕速率比在海水中的快 發布:2024/12/10 21:0:1組卷:106引用:4難度:0.7


