某學校化學興趣小組對必修二課本上的兩個實驗活動進行分組實驗。
Ⅰ.第一實驗小組用硫代硫酸鈉與硫酸反應研究反應物濃度和溫度對該反應速率的影響,設計以下三組實驗。已知硫代硫酸鈉與稀硫酸反應的方程式為:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O。
回答下列問題。
| 實驗 序號 |
反應 溫度 (℃) |
Na2S2O3溶液 | 稀硫酸 | H2O | 產生沉 淀時間 |
||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
| Ⅰ | 25 | 5 | 0.2 | 10 | 0.1 | x | t1 |
| Ⅱ | 25 | 10 | 0.1 | 10 | 0.2 | 5 | t2 |
| Ⅲ | 35 | 10 | 0.1 | 5 | y | 10 | t3 |
溫度計
溫度計
。(2)對比實驗Ⅰ、Ⅱ研究
c(H+)
c(H+)
對該反應速率的影響,x=10
10
。(3)對比實驗Ⅱ、Ⅲ研究
反應溫度
反應溫度
對該反應速率的影響,y=0.4
0.4
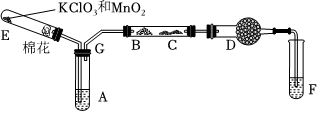
。Ⅱ.第二實驗小組設計乙醇催化氧化的實驗裝置(加熱儀器、鐵架臺、鐵夾等均已略去)。其中A為無水乙醇(沸點 78℃),B為繞成螺旋狀的細銅絲或銀絲,C為無水硫酸銅粉末,D為堿石灰,F為新制的 Cu(OH)2懸濁液。(提示:乙醛具有與葡萄糖相似的性質)
(4)加熱裝置E中的固體,目的是
提供氧氣
提供氧氣
。(5)為了使A中的乙醇平穩汽化成蒸氣,可采用目的加熱方法是
將試管A放入78℃(或略大于78℃)的熱水浴中
將試管A放入78℃(或略大于78℃)的熱水浴中
;D處使用堿石灰的作用是 防止F中的水蒸氣進入C中干擾實驗結果
防止F中的水蒸氣進入C中干擾實驗結果
。(6)乙醇催化氧化的化學方程式為
2CH3CH2OH+O22CH3CHO+2H2O
催化劑
2CH3CH2OH+O22CH3CHO+2H2O
。催化劑
(7)能證明乙醇反應后的產物的實驗現象是:圖中C處
白色固體變
白色固體變
,F處 產生磚紅色沉淀
產生磚紅色沉淀
。
【考點】探究影響化學反應速率的因素;乙酸乙酯的制取.
【答案】溫度計;c(H+);10;反應溫度;0.4;提供氧氣;將試管A放入78℃(或略大于78℃)的熱水浴中;防止F中的水蒸氣進入C中干擾實驗結果;2CH3CH2OH+O22CH3CHO+2H2O;白色固體變;產生磚紅色沉淀
催化劑
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:25引用:2難度:0.6
相似題
-
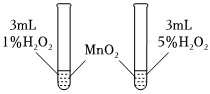 1.控制變量法是化學實驗的常用方法之一,如圖所示實驗探究影響反應速率的因素是( )
1.控制變量法是化學實驗的常用方法之一,如圖所示實驗探究影響反應速率的因素是( )A.催化劑 B.溫度 C.濃度 D.壓強 發布:2024/12/30 14:0:1組卷:44引用:3難度:0.6 -
 2.(一)Fenton法常用于處理含有難降解有機物的工業廢水,通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物.現運用該方法降解有機污染物p-CP,探究有關因素對該降解反應速率的影響.實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K下設計如下對比實驗(其余實驗條件見下表):
2.(一)Fenton法常用于處理含有難降解有機物的工業廢水,通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物.現運用該方法降解有機污染物p-CP,探究有關因素對該降解反應速率的影響.實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K下設計如下對比實驗(其余實驗條件見下表):
(1)編號③的實驗目的是實驗序號 實驗目的 T/K pH c/10-3mol?L-1 H2O2 Fe2+ ① 為以下實驗作參照物 298 3 6.0 0.30 ② 探究溫度對降解反應速率的影響 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
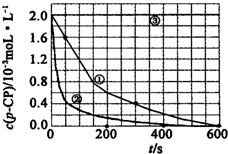
(2)實驗測得不同實驗編號中p-CP的濃度隨時間變化的關系如圖所示.請根據實驗①曲線,計算降解反應在50-300s內的平均反應速率v(p-CP)=.
(3)實驗①②表明,溫度與該降解反應速率的關系是.
(二)已知Fe3+和I-在水溶液中的反應為2I-+2Fe3+=2Fe2++I2.正向反應速率和I-、Fe3+的濃度關系為v=kcm(I-)cn(Fe3+)(k為常數)
(4)請分析下表提供的數據回答以下問題:
①在v=kcm(I-)cn(Fe3+)中,m、n的值為c(I-)/(mol?L-1) c(Fe3+)/(mol?L-1) v/(mol?L-1?s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(選填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-濃度對反應速率的影響Fe3+濃度對反應速率的影響(填“<”、“>”或“=”).
(三)一定溫度下,反應FeO(s)+CO(g)?Fe(s)+CO2(g)的化學平衡常數為3.0,該溫度下將2mol FeO、4mol CO、5mol Fe、6mol CO2加入容積為2L的密閉容器中反應.請通過計算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若將5mol FeO、4mol CO加入同樣的容器中,在相同溫度下達到平衡,則CO的平衡轉化率為.發布:2024/12/30 14:30:1組卷:19引用:2難度:0.5 -
3.為探究影響化學反應速率的因素,某研究小組設計了如下五個實驗。按要求回答下列問題(已知:Cu2+、Fe3+對H2O2的分解起催化作用)。
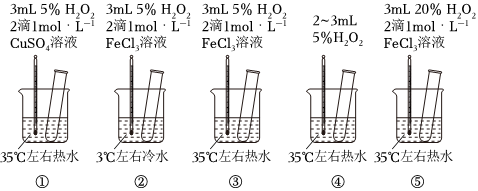
(1)為探究溫度對化學反應速率的影響,應選擇實驗(填序號,下同),選擇的依據是。
(2)為探究催化劑對化學反應速率的影響,同時探究催化劑不同催化效果不同,應選擇實驗。
(3)通過觀察發現實驗⑤比實驗③現象明顯,其原因是。
(4)根據上述實驗,用H2O2快速制取少量O2,可采取的三條措施為。發布:2024/12/30 14:30:1組卷:8引用:5難度:0.5


