2021-2022學年江西省萍鄉市高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包含14題,1-10題每題3分,11-14題每題4分,共46分。在每小題給出的四個選項中,只有一個選項符合題意)
-
1.2022年2月4日,第二十四屆冬奧會在北京開幕,北京成為世界上首個“雙奧之城”。本屆冬奧會背后蘊含了很多科技成果下列說法正確的是,( )
A.頒獎禮服內添加了石墨烯發熱材料,石墨烯和C60是同位素 B.冬奧火炬“飛揚”使用氫氣作為燃料,氫能屬于新能源 C.吉祥物冰墩墩的外殼使用了有機硅橡膠材料,屬于硅酸鹽材料 D.國家速滑館的冰面是采用超臨界二氧化碳流體跨臨界直冷制冰技術打造的,該過程是化學變化 組卷:44引用:3難度:0.7 -
2.化學與生產生活密切相關。下列說法錯誤的是( )
A.多糖、蛋白質都是高分子化合物,一定條件下都能水解 B.SiO2具有特殊的光學性能,可用于制作光導纖維 C.尼龍繩、羊絨衫和棉襯衣等生活用品都是由合成纖維制造的 D.BaSO4不溶于水和酸,可用于胃腸X射線造影檢查 組卷:18引用:2難度:0.8 -
3.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,11.2L乙醇中含H-O鍵數目為0.5NA B.常溫常壓下,1mol乙烷和乙烯的混合物完全燃燒,產生的CO2分子數目為2NA C.17.4gMnO2與40mL10mol/L濃鹽酸反應,轉移電子的數目為0.2NA D.1mol/LAlCl3溶液和1mol/L的NaCl溶液等體積混合,Cl-的數目為4NA 組卷:25引用:2難度:0.6 -
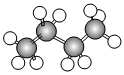 4.如圖是正丁烷的球棍模型,有關該結構說法正確的是( )
4.如圖是正丁烷的球棍模型,有關該結構說法正確的是( )A.正丁烷的分子式為C4H8 B.分子中共含有12個共價鍵 C.與甲烷互為同系物 D.存有多種(2種以上)同分異構體 組卷:31引用:2難度:0.7 -
5.下列物質相遇時,沒有發生氧化還原反應的是( )
A.氨遇到氯化氫時產生白煙 B.紅熱的木炭遇到濃硝酸產生紅棕色氣體 C.光亮的鐵釘插入濃硫酸中,無明顯現象 D.在酒精燈上灼燒后變黑的銅絲插入乙醇中,銅絲變紅 組卷:60引用:2難度:0.7 -
6.利用固體表面催化工藝進行NO分解的過程如圖所示:

下列說法不正確的是( )A.NO是有毒氣體 B.催化劑能改變NO的分解速率 C.NO分解生成N2和O2 D.過程②釋放能量,過程③吸收能量 組卷:57引用:7難度:0.7
二、填空題(本題包含4小題,共54分)
-
17.某學校化學興趣小組對必修二課本上的兩個實驗活動進行分組實驗。
Ⅰ.第一實驗小組用硫代硫酸鈉與硫酸反應研究反應物濃度和溫度對該反應速率的影響,設計以下三組實驗。已知硫代硫酸鈉與稀硫酸反應的方程式為:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O。
回答下列問題。
(1)該反應所需的儀器有:量筒、燒杯、試管、藥匙、試管架、膠頭滴管、秒表、實驗
序號反應
溫度
(℃)Na2S2O3溶液 稀硫酸 H2O 產生沉
淀時間V/mL c/(mol/L) V/mL c/(mol/L) V/mL Ⅰ 25 5 0.2 10 0.1 x t1 Ⅱ 25 10 0.1 10 0.2 5 t2 Ⅲ 35 10 0.1 5 y 10 t3 。
(2)對比實驗Ⅰ、Ⅱ研究對該反應速率的影響,x=。
(3)對比實驗Ⅱ、Ⅲ研究對該反應速率的影響,y=。
Ⅱ.第二實驗小組設計乙醇催化氧化的實驗裝置(加熱儀器、鐵架臺、鐵夾等均已略去)。其中A為無水乙醇(沸點 78℃),B為繞成螺旋狀的細銅絲或銀絲,C為無水硫酸銅粉末,D為堿石灰,F為新制的 Cu(OH)2懸濁液。(提示:乙醛具有與葡萄糖相似的性質)
(4)加熱裝置E中的固體,目的是。
(5)為了使A中的乙醇平穩汽化成蒸氣,可采用目的加熱方法是;D處使用堿石灰的作用是。
(6)乙醇催化氧化的化學方程式為。
(7)能證明乙醇反應后的產物的實驗現象是:圖中C處,F處。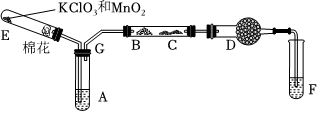 組卷:25引用:2難度:0.6
組卷:25引用:2難度:0.6 -
18.甲醇(CH3OH)是應用廣泛的化工原料和前景樂觀的燃料。
Ⅰ.一定條件下,在5L密閉容器中充入1mol CO2和3mol H2,發生反應:xCO2(g)+3H2(g)?CH3OH(g)+H2O(g)。測得CO2(g)和CH3OH(g)的物質的量隨時間變化如圖1所示。
(1)x=;0~3min內H2的平均反應速率v(H2)=mol/(L?min)。
(2)下列措施能提高正反應速率的是。(填正確答案的字母)
A.降低溫度 B.增加CO2的量 C.使用催化劑 D.及時分離出甲醇
Ⅱ.甲醇燃料電池可使甲醇作燃料時的能量轉化更高效,某種甲醇燃料電池的工作原理如圖2所示,其電極反應如下:2CH3OH+2H2O-12e-═12H++2CO2 3O2+12H++12e-═6H2O
(3)該裝置的負極是電極(填“A”或“B”);c處通入的物質是( 填“CH3OH”或“O2”)。
(4)甲醇燃料電池供電時的總反應方程式為。
(5)當該裝置消耗0.2mol甲醇時,轉移電子的數目為;若這部分電子全部用于電解水,理論上可產生氫氣L.(標準狀況)組卷:53引用:5難度:0.5


