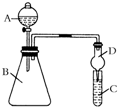
 某同學為驗證元素周期表中元素性質的遞變規律,利用如圖裝置可驗證同主族非金屬性的變化規律.設計了如下系列實驗.
某同學為驗證元素周期表中元素性質的遞變規律,利用如圖裝置可驗證同主族非金屬性的變化規律.設計了如下系列實驗.
(1)向Na2S溶液中通入氯氣出現淡黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為S2-+Cl2═S↓+2Cl-S2-+Cl2═S↓+2Cl-.
(2)儀器A的名稱為分液漏斗分液漏斗,
(3)若要證明非金屬性:Cl>I,則A中加濃鹽酸,B中加KMnO4,(KMnO4與濃鹽酸常溫下反應生成氯氣),C中加淀粉碘化鉀混合溶液,觀察到混合溶液變藍變藍的現象,即可證明.從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用NaOHNaOH溶液吸收尾氣.
(4)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3,C中加Na2SiO3溶液觀察到C中溶液有白色沉淀生成有白色沉淀生成的現象,即可證明.但有的同學認為鹽酸具有揮發性,應用飽和NaHCO3飽和NaHCO3溶液除去.
【考點】探究化學規律.
【答案】S2-+Cl2═S↓+2Cl-;分液漏斗;變藍;NaOH;有白色沉淀生成;飽和NaHCO3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:38引用:5難度:0.5
相似題
-
1.將鈉、鋁、鐵三種金屬各0.5mol,分別投入100mL2mol?L-1的鹽酸中,結果正確的是( )
A.鈉與鹽酸反應最劇烈,產生的氣體最少 B.鋁與鹽酸反應最劇烈,產生的氣體最多 C.鐵與鹽酸反應產生的氣體比鈉多 D.反應結束時鋁與鐵產生的氣體一樣多 發布:2024/12/16 17:30:2組卷:4引用:3難度:0.8 -
2.化學學習方法中的類推法是由已學知識通過遷移構建新知識的方法.下列類比正確的是( )
A.CaCO3與稀硝酸反應生成CO2,CaSO3也能與稀硝酸反應生成SO2 B.銅在Cl2中燃燒生成二價銅,銅也能在硫蒸氣中燃燒生成二價銅 C.鋅可以與溶液中的銀離子發生置換反應,鈉也能與溶液中的銀離子發生置換反應 D.鈉與乙醇反應產生氫氣,鉀與乙醇也能反應產生氫氣 發布:2024/11/1 8:0:2組卷:32引用:2難度:0.7 -
3.下列“類比”合理的是( )
已知事實 類比結論 A 濃鹽酸與過量MnO2反應會有鹽酸剩余 濃硫酸與過量銅反應也會有硫酸剩余 B CO2與Ba(NO3)2溶液不反應 SO2與Ba(NO3)2溶液也不反應 C 氫氟酸是弱酸,可以溶解SiO2 高氯酸是強酸,也可以溶解SiO2 D HCl可以用濃硫酸干燥 HBr也可用濃硫酸干燥 A.A B.B C.C D.D 發布:2024/12/21 8:0:2組卷:3引用:0難度:0.7


