2015-2016學年山西大學附中高一(下)模塊化學試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題(1-15題,每題2分,16-20題,每題3分,共45分,每小題只有一個選項)
-
1.根據元素所在元素周期表的位置,判斷下列元素都能作為半導體材料的是( )
A.S、K B.C、Al C.Si、Ge D.Ag、Cu 組卷:17引用:2難度:0.9 -
2.下列比較錯誤的是( )
A.金屬性:Na>Mg>Al B.非金屬性:Cl>S>P>Si C.堿性:NaOH>Mg(OH)2>Al(OH)3 D.酸性:HClO>H2SO3>H3PO4>H2SiO3 組卷:24引用:7難度:0.9 -
3.下列關于化學鍵的敘述中,不正確的是( )
A.離子化合物可以含共價鍵 B.共價化合物可能含離子鍵 C.離子化合物中肯定含離子鍵 D.共價化合物中不含離子鍵 組卷:11引用:3難度:0.9 -
4.下列各組粒子中屬于同位素的是( )
A.16O和18O B.H2O和D2O C.H2和D2 D.24Mg和24Na 組卷:97引用:37難度:0.9 -
5.下列敘述正確的是( )
A.同周期元素中,VⅡA族元素的原子半徑最大 B.現已發現的零族元素的單質在常溫常壓下都是氣體 C.ⅥA族元素的原子,其半徑越大,越容易得到電子 D.所有的主族元素的簡單離子的化合價與其族序數相等 組卷:26引用:4難度:0.7 -
6.下列敘述中錯誤的是( )
A.原子半徑:Cl>S>O B.還原性:Na>Mg>Al C.穩定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4 組卷:56引用:31難度:0.7 -
7.與氫氧根具有相同的質子數和電子數的微粒是( )
A.CH4 B.NH4+ C.NH2- D.Cl- 組卷:288引用:25難度:0.9 -
8.X元素的陽離子與Y元素的陰離子具有相同的電子層結構,下列敘述正確的是( )
A.原子序數X<Y B.原子半徑X<Y C.離子半徑X>Y D.原子最外層電子數X<Y 組卷:96引用:42難度:0.7
二、非選擇題(本題包括5小題,共55分)
-
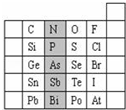 24.元素在周期表中的位置,反映了元素的原子結構和元素的性質。如圖是元素周期表的一部分。
24.元素在周期表中的位置,反映了元素的原子結構和元素的性質。如圖是元素周期表的一部分。
(1)陰影部分元素N在元素周期表中的位置為。
(2)根據元素周期律,請你預測:H3AsO4、H3PO4的酸性強弱:H3AsO4H3PO4.硫元素的最高正價和最低負價分別為、。
(3)請判斷在相同條件下Se與H2反應比S與H2反應(選填“更易”、“更難”或“相同”)。組卷:8引用:1難度:0.5 -
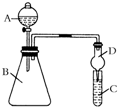 25.某同學為驗證元素周期表中元素性質的遞變規律,利用如圖裝置可驗證同主族非金屬性的變化規律.設計了如下系列實驗.
25.某同學為驗證元素周期表中元素性質的遞變規律,利用如圖裝置可驗證同主族非金屬性的變化規律.設計了如下系列實驗.
(1)向Na2S溶液中通入氯氣出現淡黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為.
(2)儀器A的名稱為,
(3)若要證明非金屬性:Cl>I,則A中加濃鹽酸,B中加KMnO4,(KMnO4與濃鹽酸常溫下反應生成氯氣),C中加淀粉碘化鉀混合溶液,觀察到混合溶液的現象,即可證明.從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用溶液吸收尾氣.
(4)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3,C中加Na2SiO3溶液觀察到C中溶液的現象,即可證明.但有的同學認為鹽酸具有揮發性,應用溶液除去.組卷:38引用:5難度:0.5


