以焦炭為原料的制氨流程示意如下:

I.“精制”過程是將含有少量CO、CO2、O2和H2S等雜質的原料氣體通入含有氨水的醋酸亞銅二氨(化學式為[Cu (NH3)2]Ac)溶液,以獲得純凈原料氣.其中,吸收CO的反應為:
CO+[Cu (NH3)2]Ac+NH3?H2O?[Cu (NH3)3CO]Ac+H2O△H<0.
(1)為提高CO吸收率,可采取的一項措施是降低溫度、增大壓強降低溫度、增大壓強.
(2)除去氧氣時,氧氣將[Cu(NH3)2]Ac氧化為[Cu(NH3)4]Ac2,則反應中還原劑與氧化劑的物質的量之比是4:14:1.
II.“造氣”過程中.其中,焦炭與水蒸氣在反應體系中將發生如下四個反應:
C(s)+2H2O(g)?CO2(g)+2H2(g)△H1=+90.2kJ?mol-1
C(s)+H2O(g)?CO(g)+H2(g)△H2=+131.4kJ?mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
C(s)+2H2(g)?CH4(g)△H4
該體系中,一些物質的平衡組成與溫度的關系圖如圖所示.
(3)由圖可知,若采用焦炭與水蒸氣反應來獲得優質的水煤氣,工業生產中應盡量使焦炭和水蒸氣在高溫高溫(填“高溫”、“低溫”或“常溫”)條件下進行.
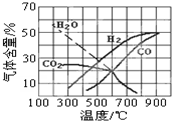 (4)△H3=-41.2KJ/mol-41.2KJ/mol.
(4)△H3=-41.2KJ/mol-41.2KJ/mol.
(5)下表為碳與氫氣合成甲烷的相關數據:
| 溫度(℃) | 600 | 800 | 1000 |
| 平衡常數 | 3.2×100-146 | 1.0×10-2070 | 1.0×10-20000 |
<
<
0(填“>”、“<”或“=”).②預測1000℃,焦炭與水蒸氣反應體系中甲烷的含量
A
A
.A.幾乎為0 B.與CO濃度相當 C.無法確定.
【答案】降低溫度、增大壓強;4:1;高溫;-41.2KJ/mol;<;A
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:63引用:3難度:0.7
相似題
-
1.工業煉鐵是在高爐中進行的,高爐煉鐵的主要反應是:①2C(焦炭)+O2(空氣)=2CO;②Fe2O3+3CO=2Fe+3CO2該煉鐵工藝中,對焦炭的實際使用量要遠遠高于按照化學方程式計算所需其主要原因是:( )
A.CO過量 B.CO與鐵礦石接觸不充分 C.煉鐵高爐的高度不夠 D.CO與Fe2O3的反應有一定限度 發布:2024/8/6 8:0:9組卷:90引用:7難度:0.7 -
2.在一密閉燒瓶中,在25℃時存在著平衡:2NO2?N2O4(正反應放熱).把燒瓶置于100℃的水中,則下列幾項性質中不會改變的是( )
①顏色;②平均分子量;③質量;④壓強;⑤密度.A.①和③ B.②和④ C.④和⑤ D.③和⑤ 發布:2024/6/27 10:35:59組卷:105引用:17難度:0.7 -
3.【化學--選修2化學與技術】
硫酸是重要的化工原料,它的產量衡量了一個國家的工業發展水平.工業生產硫酸時,利用催化氧化反應將SO2轉化SO3是一個關鍵步驟.壓強及溫度對SO2轉化率的影響如下表.(原料氣各成分的體積分數為:SO2:7%,O2:11%,N2:82%).根據信息回答下列問題:
(1)工業制硫酸時發生此反應的設備是壓強MPa
轉化率%
溫度/℃0.1 0.5 1 10 400 99.2 99.6 99.7 99.9 500 93.5 96.9 97.8 99.3 600 73.7 85.8 89.5 96.4 .
(2)已知SO2的催化氧化是放熱反應,如何利用表中數據推斷此結論?.
(3)在400℃~500℃,SO2的催化氧化采用常壓而不是高壓,主要原因是.
(4)為提高SO3的吸收率,實際生產中用吸收SO3.
(5)在此反應前必須對原料氣進行凈化的原因.
(6)已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol 每生產1000t 98%硫酸所需要的SO3的質量為t,由SO2生產這些SO3所放出的熱量為kJ.發布:2024/6/27 10:35:59組卷:42引用:2難度:0.1


