2013-2014學年湖北省荊州市沙市中學高二(上)第二次雙周練化學試卷(10月份)
發布:2024/4/20 14:35:0
一、選擇題(本題包括15小題,每小題3分,共45分,每小題只有一個選項符合題意)
-
1.下列說法中正確的是( )
A.NH4NO3溶于水吸熱,說明其溶于水不是自發過程 B.反應C(s)+CO2(g)═2CO(g)為熵增加的反應,常溫下一定自發進行 C.熵增加且放熱的反應一定是自發反應 D.非自發反應在任何條件下都不能實現 組卷:13引用:8難度:0.9 -
2.下列反應符合如圖p-υ變化曲線的是( )
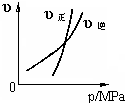
A.H2(g)+I2(g)?2HI(g) B.3NO2(g)+H2O(l)?2HNO3(l)+NO(g) C.4NH3(g)+5O2(g)?4NO(g)+6H2O(g) D.CO2(g)+C(s)?2CO(g) 組卷:54引用:5難度:0.9 -
3.下列有關化學反應速率的說法中,正確的是( )
A.100mL 2 mol/L的鹽酸與鋅反應時,加入適量的氯化鈉溶液,生成氫氣的速率不變 B.用鐵片和稀硫酸反應制取氫氣時,改用鐵片和濃硫酸可以加快產生氫氣的速率 C.二氧化硫的催化氧化是一個放熱反應,所以升高溫度,反應速率減慢 D.汽車尾氣中的CO和NO可以緩慢反應生成N2和CO2,減小壓強,反應速率減慢 組卷:368引用:31難度:0.7 -
4.下列事實不能用勒夏特列原理解釋的是( )
A.黃綠色的氯水光照后顏色變淺 B.在SO2氧化為SO3的過程中使用催化劑 C.由NO2和N2O4組成的平衡體系加壓后顏色先變深后變淺 D.在含有Fe(SCN)3的紅色溶液中加鐵粉,振蕩靜置,溶液顏色變淺或褪去 組卷:62引用:1難度:0.9 -
5.下列圖象分別表示有關反應的反應過程與能量變化的關系,據此判斷下列說法中正確的是( )

A.石墨轉變為金剛石是吸熱反應 B.白磷比紅磷穩定 C.S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,則△H1>△H2 D.CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 組卷:595引用:47難度:0.9 -
6.某溫度時,N2(g)+3H2(g)?2NH3(g)的平衡常數K=a,則此溫度下,NH3(g)?
H2(g)+32N2(g)的平衡常數為( )12A. a-12B. a12C. a12D.a-2 組卷:89引用:16難度:0.7
二、解答題(共4小題,滿分55分)
-
18.以焦炭為原料的制氨流程示意如下:

I.“精制”過程是將含有少量CO、CO2、O2和H2S等雜質的原料氣體通入含有氨水的醋酸亞銅二氨(化學式為[Cu (NH3)2]Ac)溶液,以獲得純凈原料氣.其中,吸收CO的反應為:
CO+[Cu (NH3)2]Ac+NH3?H2O?[Cu (NH3)3CO]Ac+H2O△H<0.
(1)為提高CO吸收率,可采取的一項措施是.
(2)除去氧氣時,氧氣將[Cu(NH3)2]Ac氧化為[Cu(NH3)4]Ac2,則反應中還原劑與氧化劑的物質的量之比是.
II.“造氣”過程中.其中,焦炭與水蒸氣在反應體系中將發生如下四個反應:
C(s)+2H2O(g)?CO2(g)+2H2(g)△H1=+90.2kJ?mol-1
C(s)+H2O(g)?CO(g)+H2(g)△H2=+131.4kJ?mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
C(s)+2H2(g)?CH4(g)△H4
該體系中,一些物質的平衡組成與溫度的關系圖如圖所示.
(3)由圖可知,若采用焦炭與水蒸氣反應來獲得優質的水煤氣,工業生產中應盡量使焦炭和水蒸氣在(填“高溫”、“低溫”或“常溫”)條件下進行.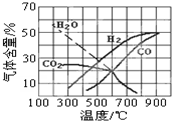 (4)△H3=.
(4)△H3=.
(5)下表為碳與氫氣合成甲烷的相關數據:
①△H4溫度(℃) 600 800 1000 平衡常數 3.2×100-146 1.0×10-2070 1.0×10-20000 0(填“>”、“<”或“=”).
②預測1000℃,焦炭與水蒸氣反應體系中甲烷的含量.
A.幾乎為0 B.與CO濃度相當 C.無法確定.組卷:63引用:3難度:0.7 -
19.“生物質”是指由植物或動物生命體衍生得到的物質的總稱.“生物質能”是人類解決能源危機的一種重要的能源.“生物質”在一定條件下可氣化為CO、H2等原料氣,進而合成甲醇和二甲醚(CH3OCH3),相關反應為:
①2H2(g)+CO(g)?CH3OH(g);
②4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g).
請根據圖1、2示回答問題:
(1)由H2和CO合成二甲醚的熱化學方程式是.
(2)在T1、T2溫度下,向兩個容積相同的密閉容器中分別通入1molCO和2molH2合成甲醇,則T1、T2溫度下對應反應的平衡常數K1K2(選填“>”、“<”或“=”).
(3)在一定條件下,向一個容積可變的密閉容器中充入4molH2、2molCO、1molCH3OCH3 (g)和1molH2O(g),經一定時間反應②達到平衡狀態,此時測得混合氣體密度是相同條件下起始時的1.6倍.反應開始時正、逆反應速率的大小關系為υ正υ逆(選填“>”、“<”或“=”),平衡時n(CH3OCH3)=mol.
(4)圖3為綠色電源“二甲醚燃料電池”的工作原理示意圖.
(a、b均為多孔性Pt電極).
a電極是極(填“正”或“負”);
b電極上的電極反應為.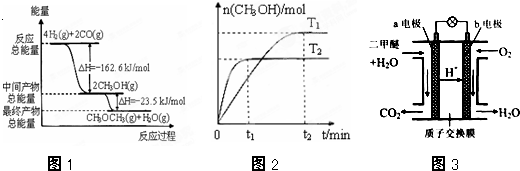 組卷:32引用:3難度:0.1
組卷:32引用:3難度:0.1


