3D打印對鈦粉末的要求很高。熔鹽電解精煉是制取鈦粉的有效途徑。精煉時(shí)一般采用等摩爾比的KCl-NaCl熔鹽,其中含有一定濃度的低價(jià)氯化鈦(TiClx,x=2、3)。(已知:①熔鹽中Ti3+少,Ti2+多熔鹽電解精煉制得的鈦粉顆粒相對粗大;②鈦的熔點(diǎn)為1668℃,TiCl4熔點(diǎn)-24.1℃、沸點(diǎn)136.4℃)。
(1)精煉時(shí),粗品質(zhì)的海綿鈦、廢鈦材等做電解池的 陽陽極。
(2)采用海綿鈦與TiCl4制取低價(jià)鈦離子的電解質(zhì)熔鹽時(shí),熔鹽中存下如下4個(gè)反應(yīng):
ⅰ.3Ti4++Ti0→4Ti3+△H1
ⅱ.Ti4++Ti0→2Ti2+△H2
ⅲ.Ti4++Ti2+→2Ti3+△H3
ⅳ.2Ti3++Ti?3Ti2+2Ti3++Ti?3Ti2+△H4
①反應(yīng)ⅳ的化學(xué)方程式為 2Ti3++Ti?3Ti2+2Ti3++Ti?3Ti2+。
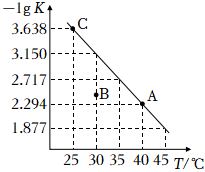
②上述4個(gè)反應(yīng)的平衡常數(shù)與溫度的關(guān)系如圖。由此可知△H1>>3△H2(填“>”、“<”或“=”)。

③有助于制取低價(jià)鈦離子的電解質(zhì)熔鹽的措施為 降低熔鹽溫度降低熔鹽溫度。
(3)向如圖裝置中加入海綿鈦,從石英管中緩慢加入amolTiCl4,恒溫條件下進(jìn)行反應(yīng)。

①平衡時(shí),測得消耗海綿鈦及TiCl4的物質(zhì)的量分別為bmol、cmol。熔鹽中低價(jià)鈦離子的平均價(jià)態(tài)為 4cb+c4cb+c。
②用各離子的物質(zhì)的量分?jǐn)?shù)表示平衡濃度,則反應(yīng)ⅲ的平衡常數(shù)K3=(2c-2b)2(3b-c)(a-c)(2c-2b)2(3b-c)(a-c)。
③若向此平衡體系中繼續(xù)注入TiCl4,則再次平衡后c平(Ti4+)c平(Ti2+) 不變不變(填“增大”、“減小”或“不變”)
(4)電解精煉制鈦粉,偶爾會得到一些相對粗大的鈦粉顆粒而影響產(chǎn)品質(zhì)量,請分析產(chǎn)生的原因 ①熔鹽電解精煉時(shí)陰極上得到的Ti粉脫附進(jìn)入熔鹽,與高價(jià)鈦反應(yīng)生成了低價(jià)的Ti2+(或TiCl2),②海綿鈦中含有其它還原性的物質(zhì)與高價(jià)鈦反應(yīng)生成了低價(jià)的Ti2+(或TiCl2)等①熔鹽電解精煉時(shí)陰極上得到的Ti粉脫附進(jìn)入熔鹽,與高價(jià)鈦反應(yīng)生成了低價(jià)的Ti2+(或TiCl2),②海綿鈦中含有其它還原性的物質(zhì)與高價(jià)鈦反應(yīng)生成了低價(jià)的Ti2+(或TiCl2)等(寫出1條原因,合理即可)。
4
c
b
+
c
4
c
b
+
c
(
2
c
-
2
b
)
2
(
3
b
-
c
)
(
a
-
c
)
(
2
c
-
2
b
)
2
(
3
b
-
c
)
(
a
-
c
)
c
平
(
T
i
4
+
)
c
平
(
T
i
2
+
)
【答案】陽;2Ti3++Ti?3Ti2+;2Ti3++Ti?3Ti2+;>;降低熔鹽溫度;;;不變;①熔鹽電解精煉時(shí)陰極上得到的Ti粉脫附進(jìn)入熔鹽,與高價(jià)鈦反應(yīng)生成了低價(jià)的Ti2+(或TiCl2),②海綿鈦中含有其它還原性的物質(zhì)與高價(jià)鈦反應(yīng)生成了低價(jià)的Ti2+(或TiCl2)等
4
c
b
+
c
(
2
c
-
2
b
)
2
(
3
b
-
c
)
(
a
-
c
)
【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:40引用:1難度:0.6
相似題
-
 1.將一定量純凈的氨基甲酸銨固體置于密閉容器中,發(fā)生反應(yīng):NH2COONH4(s)?2NH3(g)+CO2(g)。該反應(yīng)的平衡常數(shù)的負(fù)對數(shù)(-lgK)隨溫度(T)的變化如圖所示,下列說法不正確的是( )
1.將一定量純凈的氨基甲酸銨固體置于密閉容器中,發(fā)生反應(yīng):NH2COONH4(s)?2NH3(g)+CO2(g)。該反應(yīng)的平衡常數(shù)的負(fù)對數(shù)(-lgK)隨溫度(T)的變化如圖所示,下列說法不正確的是( )A.該反應(yīng)的ΔH>0 B.A點(diǎn)對應(yīng)狀態(tài)的平衡常數(shù)K(A)的值為10-2.294 C.混合氣體的平均摩爾質(zhì)量不變時(shí),可以判斷該反應(yīng)已達(dá)到平衡狀態(tài) D.30℃時(shí),B點(diǎn)對應(yīng)狀態(tài)的v(正)<v(逆) 發(fā)布:2024/12/19 1:30:1組卷:134引用:4難度:0.7 -
2.已知:NO和O2轉(zhuǎn)化為NO2的反應(yīng)機(jī)理如下:
①2NO(g)?N2O2(g)(快) ΔH1<0 平衡常數(shù)K1
②N2O2(g)+O2(g)?2NO2(g)(僈) ΔH2<0 平衡常數(shù)K2
下列說法正確的是( )A.2NO(g)+O2(g)?2NO2(g)的ΔH=-(ΔH1+ΔH2) B.②的速率大小決定2NO(g)+O2(g)?2NO2(g)的反應(yīng)速率 C. 
反應(yīng)過程中的能量變化可用圖表示D.2NO(g)+O2(g)?2NO2(g)的平衡常數(shù)K= K1K2發(fā)布:2024/10/31 4:30:1組卷:55引用:3難度:0.8 -
3.Ⅰ.某溫度下,在一個(gè)容積可變的密閉容器中,反應(yīng)2A(g)+B(g)?2C(g)達(dá)到平衡時(shí),A、B、C的物質(zhì)的量分別為4mol、2mol和4mol,此時(shí)容器容積為4L.則此溫度下該反應(yīng)的平衡常數(shù)K=
.保持溫度和壓強(qiáng)不變,將各組分的物質(zhì)的量都減少1mol,此時(shí),容器的容積為,該反應(yīng)的濃度商Q=.此時(shí),平衡移動(填“向左”、“向右”或“不”)
Ⅱ.2007年度中國國家科學(xué)技術(shù)最高獎授予了石油化工催化專家閔恩澤,以表彰他在催化劑研究方面作出的突出貢獻(xiàn).氯化汞(HgCl2)和氯化鋁(AlCl3)都有有機(jī)化工生產(chǎn)中常用的催化劑.
(1)氯化汞是一種能溶于水的白色固體,熔點(diǎn)276℃,是一種弱電解質(zhì),在水溶液中分步電離,寫出其第一步電離的方程式.
氯化汞可以被氯化亞鐵在溶液中還原為氯化亞汞(Hg2Cl2,白色沉淀),寫出該反應(yīng)的離子方程式
若該反應(yīng)是一個(gè)可逆反應(yīng),寫出在常溫下該反應(yīng)的平衡常數(shù)表達(dá)式.
(2)無水氯化鋁用作石油裂解及催化重整的催化劑.能否直接加熱蒸干氯化鋁水溶液獲得無水氯化鋁?為什么?(用簡要的文字?jǐn)⑹龊捅匾幕瘜W(xué)方程式說明).發(fā)布:2024/11/18 8:0:1組卷:10引用:1難度:0.3
相關(guān)試卷


