氫氧化鈉是重要的化工原料。某興趣小組對氫氧化鈉進行了如下探究:
Ⅰ.氫氧化鈉的制備
用氯化鈉溶液制備氫氧化鈉的部分流程如下:

(1)在實驗室中進行操作①時,常采取的措施有 加入氯化鈉或蒸發(fā)溶劑加入氯化鈉或蒸發(fā)溶劑(任寫一種)。
(2)操作②發(fā)生反應(yīng)的化學(xué)方程式為 2NaCl+2H2O 通電 2NaOH+H2↑+Cl2↑2NaCl+2H2O 通電 2NaOH+H2↑+Cl2↑。
(3)取少量通過上述流程制得的氫氧化鈉樣品于燒杯中,向其中加入足量稀硝酸,再滴入硝酸銀溶液,有白色沉淀生成,說明樣品中含有 NaCl或氯離子NaCl或氯離子。
Ⅱ.氫氧化鈉的性質(zhì)
(4)某小組將酚酞溶液滴入NaOH溶液中,溶液變?yōu)榧t色,一段時間后紅色消失。
【提出問題】滴有酚酞的NaOH溶液由紅色褪為無色的原因是什么?
【猜想與假設(shè)】
甲同學(xué):酚酞與O2發(fā)生了反應(yīng);
乙同學(xué):NaOH溶液與空氣中的CO2發(fā)生了反應(yīng);
丙同學(xué):與NaOH溶液濃度大小有關(guān)。
【設(shè)計與實驗】三位同學(xué)為驗證各自的猜想,設(shè)計并進行了如下實驗。
①甲同學(xué)取少量實驗中的NaOH溶液于試管中,加熱煮沸,冷卻后滴入酚酞溶液,并迅速向試管中滴入植物油,植物油的作用是 隔絕氧氣隔絕氧氣。
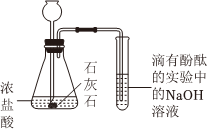
②乙同學(xué)進行如圖所示實驗,試管中溶液的紅色褪去,他認為自己的猜想正確。丁同學(xué)認為該現(xiàn)象不能佐證乙同學(xué)的猜想,理由是 濃鹽酸具有揮發(fā)性,揮發(fā)出的氯化氫能和氫氧化鈉反應(yīng),使溶液的紅色褪去濃鹽酸具有揮發(fā)性,揮發(fā)出的氯化氫能和氫氧化鈉反應(yīng),使溶液的紅色褪去。
③丙同學(xué)取質(zhì)量分數(shù)為30%和0.5%的NaOH溶液各2mL分別置于1、2號試管中,滴入數(shù)滴酚酞溶液,觀察到1號試管中紅色很快褪去,2號試管中 紅色無明顯變化紅色無明顯變化;由此判斷自己的猜想正確。
Ⅲ.氫氧化鈉的用途
(5)某“管道疏通劑”的成分為氫氧化鈉固體、鋁粉、硝酸鈉。其工作原理是鋁和氫氧化鈉遇水反應(yīng)(原理為2Al+2NaOH+2H2O=2NaAlO2+3H2↑)放出大量的熱,能加快氫氧化鈉對毛發(fā)等淤積物的腐蝕;產(chǎn)生的氣體能增加管道內(nèi)的氣壓,利于疏通。
①使用該疏通劑時要防止明火,原因是該疏通劑與水反應(yīng)產(chǎn)生的 氫氣氫氣在空氣中遇到明火可能會引起爆炸。
②檢驗發(fā)現(xiàn),該疏通劑與水反應(yīng)前后硝酸鈉的質(zhì)量和化學(xué)性質(zhì)均未改變。由此,同學(xué)們猜測:硝酸鈉可能是鋁粉和氫氧化鈉溶液反應(yīng)的催化劑。請設(shè)計實驗判斷此猜想是否正確,簡述實驗過程(包括操作、現(xiàn)象和結(jié)論):在試管1中加入少量鋁粉,在試管2中加入等質(zhì)量的鋁粉和少量硝酸鈉粉末,向兩支試管中同時加入等體積的氫氧化鈉溶液,若試管2中氣泡明顯較多,則猜想正確,否則猜想錯誤(合理即可)在試管1中加入少量鋁粉,在試管2中加入等質(zhì)量的鋁粉和少量硝酸鈉粉末,向兩支試管中同時加入等體積的氫氧化鈉溶液,若試管2中氣泡明顯較多,則猜想正確,否則猜想錯誤(合理即可)。(實驗中必須使用的試劑:鋁粉、氫氧化鈉溶液、硝酸鈉粉末)
通電
通電
【考點】實驗探究物質(zhì)變化的條件和影響物質(zhì)變化的因素;催化劑的特點與催化作用;堿的化學(xué)性質(zhì);鹽的化學(xué)性質(zhì);物質(zhì)的相互轉(zhuǎn)化和制備.
【答案】加入氯化鈉或蒸發(fā)溶劑;2NaCl+2H2O 2NaOH+H2↑+Cl2↑;NaCl或氯離子;隔絕氧氣;濃鹽酸具有揮發(fā)性,揮發(fā)出的氯化氫能和氫氧化鈉反應(yīng),使溶液的紅色褪去;紅色無明顯變化;氫氣;在試管1中加入少量鋁粉,在試管2中加入等質(zhì)量的鋁粉和少量硝酸鈉粉末,向兩支試管中同時加入等體積的氫氧化鈉溶液,若試管2中氣泡明顯較多,則猜想正確,否則猜想錯誤(合理即可)
通電
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/5/31 8:0:9組卷:84引用:2難度:0.5
相似題
-
1.如圖1為實驗室常用的制取氣體的實驗裝置。
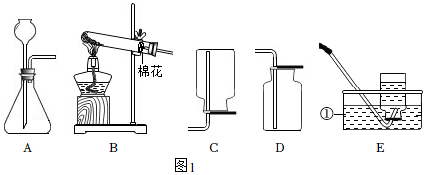
(1)寫出標有序號的儀器名稱:①。
(2)用裝置B和E組合制取氧氣,反應(yīng)方程式為,若實驗結(jié)束時先熄滅酒精燈,再移出導(dǎo)氣管,導(dǎo)致的后果為。
(3)實驗室用稀硫酸和鋅粒制取氫氣的反應(yīng)方程式為,用A裝置做發(fā)生裝置,檢查裝置氣密性時用止水夾夾緊導(dǎo)管,向長頸漏斗中加入水,若出現(xiàn)現(xiàn)象,則氣密性良好。
(4)實驗室用未知濃度的鹽酸和大理石制取二氧化碳,反應(yīng)方程式為。同學(xué)們將制得的氣體通入澄清石灰水,未變渾濁。猜想可能的原因是:
①澄清石灰水已變質(zhì);
②氣體中除了有CO2外,還有氯化氫氣體。
經(jīng)過討論設(shè)計如圖2裝置進行探究。試管I、試管Ⅱ盛放AgNO3溶液,試管Ⅲ中盛放原瓶中的澄清石灰水。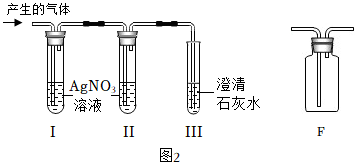
實驗過程:
根據(jù)試管I中的現(xiàn)象,試管Ⅱ中硝酸銀溶液未變渾濁,試管Ⅲ中的現(xiàn)象,同學(xué)們得出猜想①②兩個原因均存在的結(jié)論。
問題討論:
①試管Ⅱ中AgNO3溶液的作用為。
②同學(xué)們用F裝置除去CO2中的氯化氫氣體,F(xiàn)裝置中的藥品可選用(填序號)。
A.NaOH溶液
B.AgNO3溶液
C.飽和NaHCO3溶液發(fā)布:2024/12/24 8:0:11組卷:83引用:3難度:0.6 -
2.實驗小組研究幾種常用胃藥的抗酸效果。
【查閱資料】
i.溶液的pH越大,酸性越弱。人體胃液的主要成分為鹽酸,正常pH范圍為0.9~1.5。
ⅱ.三種胃藥的有效成分如下。胃藥使用不當(dāng),可能導(dǎo)致胃脹氣等癥狀。
【進行實驗】胃藥a 胃藥b 胃藥c 碳酸氫鈉
NaHCO3鋁碳酸鎂
Al2Mg6(OH)16CO3?4H2O氫氧化鋁
Al(OH)3
實驗一:驗證胃藥是否能抗酸
各取25mLpH=1.20的稀鹽酸放入三個小燒杯中,分別加入有效成分質(zhì)量相同的三種胃藥,攪拌120s,觀察實驗現(xiàn)象并用pH傳感器測定反應(yīng)后溶液的pH。
(1)胃藥a和胃藥b產(chǎn)生的氣體均為CO2,實驗室檢驗該氣體的試劑是現(xiàn)象 反應(yīng)后溶液的pH 胃藥a 產(chǎn)生大量氣體 6.37 胃藥b 產(chǎn)生極少量氣體 4.25 胃藥c 無氣體 1.34 。
(2)胃藥c中的氫氧化鋁與鹽酸發(fā)生中和反應(yīng),其化學(xué)方程式為。
(3)由實驗一可知三種胃藥都能抗酸,依據(jù)是。
實驗二:探究影響胃藥抗酸效果的因素
下表所示實驗中,均取25mLpH=1.20的稀鹽酸,加入胃藥,攪拌,用pH傳感器測定一定反應(yīng)時間后溶液的pH(反應(yīng)后pH越大,抗酸效果越好)。
(4)探究反應(yīng)時間對胃藥抗酸效果的影響的實驗組合是實驗編號 胃藥種類 有效成分質(zhì)量/g 反應(yīng)時間/s 溶液的pH ① 胃藥a 0.5 60 6.02 ② 胃藥a 0.5 120 6.37 ③ 胃藥a 0.5 180 6.54 ④ 胃藥b 0.5 60 3.93 ⑤ 胃藥b 0.5 120 4.25 ⑥ 胃藥b 0.5 180 4.70 ⑦ 胃藥c 0.5 60 1.26 ⑧ 胃藥c 0.5 120 1.34 ⑨ 胃藥c 0.5 180 1.42 (填序號,任寫一個組合)。
(5)由實驗二可知,胃藥種類對抗酸效果的影響的結(jié)論是。
【反思與評價】
(6)實際應(yīng)用中,胃藥b比胃藥a、c使用得更多。結(jié)合上述實驗,說明胃藥b具有的優(yōu)勢是。發(fā)布:2024/12/25 13:0:1組卷:179引用:2難度:0.5 -
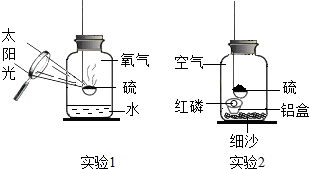 3.壽春中學(xué)化學(xué)組的同學(xué)設(shè)計了硫在氧氣中燃燒的改良實驗,如實驗1.當(dāng)火焰熄滅后發(fā)現(xiàn)留有剩余,硫為什么會熄滅呢?每個人都提出了自己的猜想.
3.壽春中學(xué)化學(xué)組的同學(xué)設(shè)計了硫在氧氣中燃燒的改良實驗,如實驗1.當(dāng)火焰熄滅后發(fā)現(xiàn)留有剩余,硫為什么會熄滅呢?每個人都提出了自己的猜想.
【猜想】
甲同學(xué)猜想:硫燃燒耗盡了瓶內(nèi)的氧氣,所以它熄滅了;
乙同學(xué)猜想:硫燃燒后瓶內(nèi)的二氧化硫(不支持硫的燃燒)濃度過高導(dǎo)致硫熄滅了;
丙同學(xué)猜想:甲和乙都只看到了問題的一個方面,他認為甲和乙都有道理;
丁同學(xué)猜想:.
【設(shè)計實驗】丁同學(xué)設(shè)計了實驗2進行實驗驗證自己的猜想:
【實驗反思】(1)硫燃燒的化學(xué)方程式為實驗步驟 實驗現(xiàn)象 實驗分析 實驗結(jié)論 (1)把少量紅磷放在鋁制小盒內(nèi),然后放入裝有細沙的集氣瓶,塞緊瓶塞,用放大鏡點燃硫,觀察現(xiàn)象. 硫燃燒一會兒就熄滅了. 磷燃燒需滿足的條件:①溫度達到著火點;
②丁同學(xué)的猜想正確. (2)待冷卻后,用放大鏡聚光加熱鋁盒內(nèi)的紅磷,觀察現(xiàn)象. 紅磷燃燒,放出熱量的同時產(chǎn)生了 ;實驗2中硫燃燒的火焰顏色是色.
(2)實驗1與課本實驗相比,實驗1的優(yōu)點是;
(3)實驗2中細沙的作用是.
(4)實驗室中測定空氣中氧氣體積分數(shù)實驗不用硫代替紅磷的原因是.發(fā)布:2024/12/2 8:0:1組卷:31引用:1難度:0.5
相關(guān)試卷


