國家主席習近平指出,為推動實現碳達峰、碳中和目標,我國將陸續發布重點領域和行業碳達峰實施方案和一系列支撐保障措施,構建起碳達峰碳中和“1+N”政策體系。二氧化碳加氫可轉化為二甲醚,既可以降低二氧化碳排放量,也可以得到性能優良的汽車燃料。
回答下列問題:
(1)制取二甲醚的熱化學方程式為:2CO2(g)+6H2(g)?CH3OCH(g)+3H2O(g) ΔH。則ΔH=-121.5kJ/mol-121.5kJ/mol。
已知:①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1=-49.0kJ?mol-1。
②2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ?mol-1。
(2)往一容積為2 L的恒容密閉容器中通入2molCO和6molH2,一定溫度下發生反應:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)。起始總壓為Po,20min時達到化學平衡狀態,測得CH3OCH3的物質的量分數為12.5%。
①達到化學平衡狀態時,下列有關敘述正確的是 ADAD(填字母序號)。
a.容器內氣體壓強不再發生改變
b.正、逆反應速率相等且均為零
c.向容器內再通入1molCO2和3molH2,重新達平衡后CH3OCH3體積分數增大
d.向容器內通入少量氦氣,則平衡向正反應方向移動
②0~20min內,用H2表示的平均反應速率v(H2)=0.1mol/(L?min)0.1mol/(L?min),CO2的平衡轉化率α(CO2)=66.7%66.7%;該溫度下,反應的平衡常數Kp=768P40768P40(用含P0的式子表達,用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
③升高溫度,二甲醚的平衡產率 減小減小(填“增大”、“減小”或“不變”),簡述理由:二甲醚的合成反應為放熱反應,升高溫度,平衡逆向移動,二甲醚產率減小二甲醚的合成反應為放熱反應,升高溫度,平衡逆向移動,二甲醚產率減小。
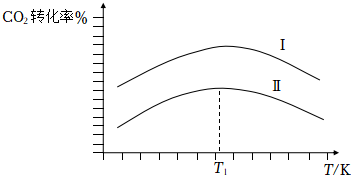
④工業上,CO2與H2混合氣體以一定的比例和一定流速分別通過填充有催化劑Ⅰ、Ⅱ的反應器,CO2轉化率與溫度的關系如圖。在催化劑Ⅱ作用下,溫度高于T1時,CO2轉化率下降的原因可能是 催化劑的活性降低催化劑的活性降低。
768
P
4
0
768
P
4
0
【考點】化學平衡的計算;用蓋斯定律進行有關反應熱的計算.
【答案】-121.5kJ/mol;AD;0.1mol/(L?min);66.7%;;減小;二甲醚的合成反應為放熱反應,升高溫度,平衡逆向移動,二甲醚產率減小;催化劑的活性降低
768
P
4
0
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:47引用:3難度:0.5
相似題
-
1.氫氣最早于16世紀被人工制取出來,氫氣是一種清潔能源。
(1)利用光伏電池電解水制H2是氫能的重要來源。已知:H-H鍵、O=O鍵、H-O鍵的鍵能依次為436kJ?mol-1、495kJ?mol-1、463kJ?mol-1。則2H2O(g)═2H2(g)+O2(g)△H=kJ?mol-1。
(2)T1℃時,向5L恒容密閉容器中充入0.5molCH4,只發生反應2CH4(g)?C2H4(g)+2H2(g),達到平衡時,測得c(C2H4)=2c(CH4),CH4的轉化率為;保持其他條件不變,溫度改為T2℃,經25s后達到平衡,測得c(CH4)=2c(C2H4),則0~25s內v(C2H4)=mol?L-1?s-1。
(3)CH4分解時幾種氣體的平衡分壓(pPa)的對數值lgp與溫度的關系如圖所示。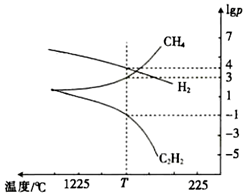
①T℃時,向一恒容密閉容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只發生反應2CH4(g)?C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此時的平衡常數Kp=(用平衡分壓代替濃度進行計算)Pa2。
②若只改變一個反應條件使Kp變大,則該條件是(填標號)。
A.減小C2H2的濃度
B.升高溫度
C.增大壓強
D.加入合適的催化劑
(4)工業上,以KNH2和液氨為電解質,以石墨為電極,電解液氨制備H2。陽極的電極反應式為,一段時間后陰、陽兩極收集到的氣體質量之比為。發布:2025/1/4 8:0:1組卷:9引用:3難度:0.5 -
2.反應 4A(g)+5B(g)?4C(g)+6D(g)在 5L 的密閉容器中進行,半分鐘后,C 的物質的量增 加了 0.30mol。下列敘述正確的是( )
A.容器中 D 的物質的量至少為 0.45 mol B.A 的平均反應速率是 0.010 mol?L-1?s-1 C.容器中 A、B、C、D 的物質的量之比一定是 4:5:4:6 D.容器中 A 的物質的量一定增加了 0.30 mol 發布:2024/12/30 19:30:2組卷:67引用:6難度:0.6 -
3.將等物質的量的A、B混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)?xC(g)+2D(g),經5min后,測得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的平均反應速率為0.1mol/(L?min).求:
(1)此時A的濃度c(A)=mol/L,反應開始前容器中的A、B的物質的量:n(A)=n(B)=mol;
(2)B的平均反應速率v(B)=mol/(L?min);
(3)x的值為.發布:2024/12/30 19:0:1組卷:163引用:26難度:0.3


