汽車尾氣中含有CO、NO、NO2等有毒氣體,對汽車加裝尾氣凈化裝置,使用催化劑催化,可使有毒氣體相互反應轉化成無毒氣體。
(1)氮氧化物間可以相互轉化
已知2NO(g)+O2(g)=2NO2(g)的反應歷程分兩步:
第一步:2NO(g)=N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)=2NO2(g)(慢反應)
①用O2表示的速率方程為v(O2)=k1?c2(NO)?c(O2);NO2表示的速率方程為v(NO2)=k2?c2(NO)?c(O2),k1與k2分別表示速率常數(與溫度有關),則k1k2=1212。
②下列關于反應2NO(g)+O2(g)=2NO2(g)的說法正確的是 BB(填序號)。
A.增大壓強,反應速率常數一定增大
B.第一步反應的活化能小于第二步反應的活化能
C.反應的總活化能等于第一步和第二步反應的活化能之和
(2)容積均為1L的甲、乙兩個容器,其中甲為絕熱容器,乙為恒溫容器.相同溫度下,分別充入0.2mol的NO2,發生反應:2NO2(g)=N2O4(g)△H<0,甲中NO2的相關量隨時間變化如圖所示。
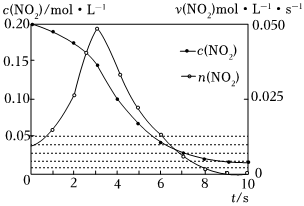
①0~3s內,甲容器中NO2反應速率增大的原因是 0~3s內溫度升高對反應速率影響大于濃度降低的影響0~3s內溫度升高對反應速率影響大于濃度降低的影響。
②甲達平衡時,溫度若為T℃,此溫度下的平衡常數K=225225。
③平衡時,K甲<<K乙,P甲>>P乙(填“>”、“<”或“=”)。
(3)CO還原法處理NO:原理為2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-746kJ/mol。在容積為2L的某密閉容器中充入4molCO和4molNO,發生該反應。平衡體系中NO的體積分數與溫度、體系總壓強的關系如圖所示。
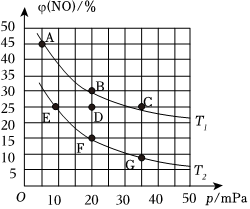
①下列有關說法正確的是 bcbc(填代號)。
a.溫度:T2>T1
b.NO的平衡轉化率:F>D>B
c.反應速率:C>D>E
②某溫度下,上述反應進行5min時放出的熱量為373kJ,則N2的平均反應速率v(N2)=0.050.05mol?L?1?min-1。
③圖中E點,N2的體積分數為 16.7%16.7%%。
k
1
k
2
1
2
1
2
【答案】;B;0~3s內溫度升高對反應速率影響大于濃度降低的影響;225;<;>;bc;0.05;16.7%
1
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:42引用:1難度:0.5
相似題
-
1.氫氣最早于16世紀被人工制取出來,氫氣是一種清潔能源。
(1)利用光伏電池電解水制H2是氫能的重要來源。已知:H-H鍵、O=O鍵、H-O鍵的鍵能依次為436kJ?mol-1、495kJ?mol-1、463kJ?mol-1。則2H2O(g)═2H2(g)+O2(g)△H=kJ?mol-1。
(2)T1℃時,向5L恒容密閉容器中充入0.5molCH4,只發生反應2CH4(g)?C2H4(g)+2H2(g),達到平衡時,測得c(C2H4)=2c(CH4),CH4的轉化率為;保持其他條件不變,溫度改為T2℃,經25s后達到平衡,測得c(CH4)=2c(C2H4),則0~25s內v(C2H4)=mol?L-1?s-1。
(3)CH4分解時幾種氣體的平衡分壓(pPa)的對數值lgp與溫度的關系如圖所示。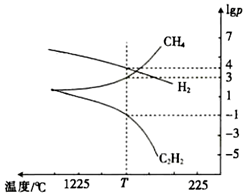
①T℃時,向一恒容密閉容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只發生反應2CH4(g)?C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此時的平衡常數Kp=(用平衡分壓代替濃度進行計算)Pa2。
②若只改變一個反應條件使Kp變大,則該條件是(填標號)。
A.減小C2H2的濃度
B.升高溫度
C.增大壓強
D.加入合適的催化劑
(4)工業上,以KNH2和液氨為電解質,以石墨為電極,電解液氨制備H2。陽極的電極反應式為,一段時間后陰、陽兩極收集到的氣體質量之比為。發布:2025/1/4 8:0:1組卷:9引用:3難度:0.5 -
2.反應 4A(g)+5B(g)?4C(g)+6D(g)在 5L 的密閉容器中進行,半分鐘后,C 的物質的量增 加了 0.30mol。下列敘述正確的是( )
A.容器中 D 的物質的量至少為 0.45 mol B.A 的平均反應速率是 0.010 mol?L-1?s-1 C.容器中 A、B、C、D 的物質的量之比一定是 4:5:4:6 D.容器中 A 的物質的量一定增加了 0.30 mol 發布:2024/12/30 19:30:2組卷:67引用:6難度:0.6 -
3.將等物質的量的A、B混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)?xC(g)+2D(g),經5min后,測得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的平均反應速率為0.1mol/(L?min).求:
(1)此時A的濃度c(A)=mol/L,反應開始前容器中的A、B的物質的量:n(A)=n(B)=mol;
(2)B的平均反應速率v(B)=mol/(L?min);
(3)x的值為.發布:2024/12/30 19:0:1組卷:163引用:26難度:0.3


