鐵是應用最廣泛的金屬,鐵的鹵化物、氧化物以及高價鐵的含氧酸鹽均為重要化合物。
(1)要確定鐵的某氯化物FeClx的化學式。實驗中稱取0.54g的FeClx樣品,溶解后先進行陽離子交換預處理,再通過含有飽和OH-的陰離子交換柱,使Cl-和OH-完全發生交換。交換完成后,流出溶液的OH-恰好被用0.40mol?L-1的鹽酸25.00mL完全中和。計算FeClx中x值為33;(保留整數)
(2)現有一含有FeCl2和FeCl3的混合物樣品,采用上述方法測得n(Fe):n(Cl)=1:2.1,則該樣品中FeCl3的物質的量分數為10%10%。在實驗室中,FeCl2可用鐵粉和鹽酸鹽酸反應制備,FeCl3可用鐵粉和氯氣氯氣反應制備;
(3)FeCl3與氫碘酸反應時可生成棕色物質,該反應的離子方程式為2Fe3++2I-=2Fe2++I22Fe3++2I-=2Fe2++I2;
(4)高鐵酸鉀(K2FeO4)是一種強氧化劑,可作為水處理劑和高容量電池材料。FeCl3與KClO在強堿性條件下反應可制取K2FeO4,其反應的離子方程式為2Fe3++10OH-+3ClO-═2FeO2-4+3Cl-+5H2O或2Fe(OH)3+4OH-+3ClO-═2FeO2-4+3Cl-+5H2O2Fe3++10OH-+3ClO-═2FeO2-4+3Cl-+5H2O或2Fe(OH)3+4OH-+3ClO-═2FeO2-4+3Cl-+5H2O。
F
e
O
2
-
4
F
e
O
2
-
4
F
e
O
2
-
4
F
e
O
2
-
4
【考點】復雜化學式的確定;鐵鹽和亞鐵鹽的相互轉化.
【答案】3;10%;鹽酸;氯氣;2Fe3++2I-=2Fe2++I2;2Fe3++10OH-+3ClO-═2+3Cl-+5H2O或2Fe(OH)3+4OH-+3ClO-═2+3Cl-+5H2O
F
e
O
2
-
4
F
e
O
2
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:85引用:2難度:0.5
相似題
-
1.三硅酸鎂為白色無味粉末,不溶于水和乙醇,易與無機酸反應.有關部門規定三硅酸鎂樣品中含水量不超過12.2%為優良級.某化學興趣小組欲測定三硅酸鎂的化學式(可用MgxSi3Oy?mH2O表示),實驗步驟如下:
步驟一:取16.6g三硅酸鎂樣品,充分加熱至不再分解,冷卻、稱量,得固體13.0g.
步驟二:另取16.6g三硅酸鎂樣品,向其中加入足量100mL 4mol/L的鹽酸,充分反應后,過濾、洗滌、灼燒,得固體9.0g.該固體為空間網狀結構,且熔沸點很高.
(1)通過計算確定MgxSi3Oy?mH2O的化學式.
(2)該小組測定的三硅酸鎂樣品是否為優良級?
(3)寫出該三硅酸鎂樣品與鹽酸反應的化學方程式.發布:2024/6/27 10:35:59組卷:61引用:2難度:0.5 -
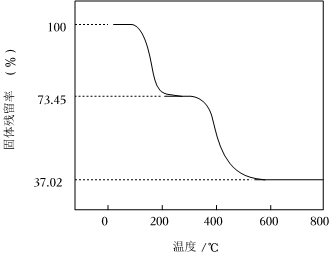 2.堿式碳酸鋁鎂[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃劑。
2.堿式碳酸鋁鎂[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃劑。
(1)堿式碳酸鋁鎂具有阻燃作用,是由于其受熱分解需吸收大量熱量和。
(2)[MgaAlb(OH)c(CO3)d?xH2O]中的a、b、c、d的代數關系式為。
(3)為確定堿式碳酸鋁鎂的組成,進行如下實驗:
①準確稱取3.390g樣品與足量稀鹽酸充分反應,生成CO2 0.560L(已換算成標準狀況下)。
②另取一定量樣品在空氣中加熱,樣品的固體殘留率(×100%)隨溫度的變化如圖所示(樣品在270℃時已完全失去結晶水,600℃以上殘留固體為金屬氧化物的混合物)。固體樣品的剩余質量固體樣品的起始質量
根據以上實驗數據計算堿式碳酸鋁鎂樣品中的n(OH-):n()(寫出計算過程)。CO2-3發布:2024/4/20 14:35:0組卷:353引用:7難度:0.3 -
3.硫酸鐵銨可用作媒染劑和制藥,其晶體化學式為(NH4)aFeb(SO4)c?dH2O.實驗室模擬用廢鐵屑(主要成分為Fe和少量的Al雜質)制取硫酸鐵銨晶體并回收氧化鋁,具體流程如圖1示:

(1)步驟①中發生的離子方程式為:.
(2)實驗中需配制500mL1.00mol?L-1的硫酸,則需要用量筒量取質量分數為98%,密度為1.84g?mL-1的濃硫酸mL,若定容時俯視刻度線,則配制的稀硫酸的濃度將(填“偏大”或“偏小”或“不變”).配制過程中不需要用到的儀器是(填字母),除圖2有儀器外,還缺少的一種玻璃儀器是.
(3)步驟②中加入足量H2O2的目的是.
(4)硫酸鐵銨晶體組成的測定
步驟1:準確稱取質量為4.820g固體在酸性條件下溶于水配成100.00mL溶液A;
步驟2:取25.00mL溶液A,加入足量的BaCl2溶液,過濾得1.165g沉淀;
步驟3:取25.00mL溶液A,加入足量氫氧化鈉溶液,過濾、洗滌并灼燒得0.2g紅棕色固體;
通過計算確定a:b:c=.(寫出計算過程)發布:2024/6/27 10:35:59組卷:75引用:3難度:0.6


