當(dāng)前位置:
知識(shí)點(diǎn)挑題
請(qǐng)展開(kāi)查看知識(shí)點(diǎn)列表
>
<
更多>>
 已完結(jié)
已完結(jié)
|
期末復(fù)習(xí)
典型試卷
考前必刷
瀏覽次數(shù):809
更新:2025年06月03日
|
 已完結(jié)
已完結(jié)
|
熱點(diǎn)預(yù)測(cè)
高考復(fù)習(xí)
難題搶練
瀏覽次數(shù):1117
更新:2025年05月26日
|
431.氨分子的空間結(jié)構(gòu)是三角錐形,而甲烷分子的空間結(jié)構(gòu)是正四面體形,這是因?yàn)椋ā 。?/h2>
A.兩種分子的中心原子的雜化軌道類(lèi)型不同,NH3中氮原子為sp2雜化,而CH4中碳原子為sp3雜化 B.NH3分子中氮原子形成3個(gè)雜化軌道,CH4分子中碳原子形成4個(gè)雜化軌道 C.NH3分子中有一對(duì)未成鍵的孤電子對(duì),它對(duì)成鍵電子對(duì)的排斥作用較強(qiáng) D.氨分子是4原子化合物,甲烷分子是5原子化合物 發(fā)布:2024/12/30 18:30:1組卷:6引用:3難度:0.6432.砷化鎵(GaAs)是優(yōu)良的半導(dǎo)體材料,可用于制作微型激光器或太陽(yáng)能電池的材料等,氮、磷、砷位于同一主族,回答下列問(wèn)題:
(1)寫(xiě)出基態(tài)As原子的核外電子排布式。
(2)根據(jù)元素周期律,原子半徑GaAs,第一電離能GaAs.(填“大于”或“小于”)
(3)氮原子的L層中有對(duì)成對(duì)電子,NH4+的立體構(gòu)型是,其中心原子的雜化方式為;PCl3屬于含有鍵的分子(填“極性”或“非極性”)。發(fā)布:2024/12/30 18:30:1組卷:6引用:2難度:0.5433.白磷燃燒的能量變化如圖甲所示,白磷及產(chǎn)物的結(jié)構(gòu)如圖乙所示,下列說(shuō)法不正確的是( )
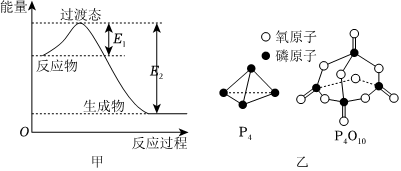
A.白磷燃燒放出的熱量為E2-E1 B.1個(gè)白磷分子中含6個(gè)P-P鍵 C.1molP4O10中σ鍵的數(shù)目為16NA D.假設(shè)P-P、P-O、O=O鍵的鍵能分別為a、b、c,則P=O鍵的鍵能為 6a+5c-12b-(E2-E1)4發(fā)布:2024/12/30 18:30:1組卷:14引用:4難度:0.6434.處于一定空間運(yùn)動(dòng)狀態(tài)的電子在原子核外出現(xiàn)的概率密度分布可用
形象化描述.在基態(tài)14C原子中,核外存在對(duì)自旋方向相反的電子.O、Na、P、Cl四種元素中電負(fù)性最大的是(填元素符號(hào)),其中磷原子的核外電子排布式為.發(fā)布:2024/12/30 18:30:1組卷:11引用:2難度:0.5435.下列模型分別表示C2H2、S8、SF6的結(jié)構(gòu),下列說(shuō)法不正確的是( )

A.32gS8分子中含有1molσ鍵 B.SF6分子中所有原子均達(dá)到8電子飽和結(jié)構(gòu) C.1molC2H2分子中有3molσ鍵和 2molπ鍵 D.1molS8中含有8molS-S鍵 發(fā)布:2024/12/30 18:30:1組卷:7引用:2難度:0.5436.下列有關(guān)共價(jià)鍵的形成的說(shuō)法錯(cuò)誤的是( )
A.原子間形成共價(jià)鍵,體系的能量降低 B.原子間形成共價(jià)鍵后,原子核間的距離更近時(shí),體系的能量會(huì)更低 C.原子間形成共價(jià)鍵時(shí),電子云在空間部分重疊 D.共用電子對(duì)在形成共價(jià)鍵的原子核之間區(qū)域出現(xiàn)的概率較大 發(fā)布:2024/12/30 18:30:1組卷:8引用:2難度:0.8437.已知短周期元素的離子aA2+、bB+、cC3-、dD-都具有相同的電子層結(jié)構(gòu),則下列敘述正確的是( )
A.原子半徑:A>B>D>C B.原子序數(shù):d>c>b>a C.離子半徑:C3->D->B+>A2+ D.元素的第一電離能:A>B>D>C 發(fā)布:2024/12/30 18:30:1組卷:7引用:3難度:0.6438.試回答下列問(wèn)題:
(1)碳酸亞乙烯酯是鋰離子電池低溫電解液的重要添加劑,其結(jié)構(gòu)為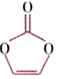 。該分子中含
。該分子中含
個(gè)σ鍵,已知鍵能數(shù)據(jù)如表所示:
則該物質(zhì)與H發(fā)生加成反應(yīng)時(shí),最易斷裂的化學(xué)鍵為化學(xué)鍵 C-O C-C C=C C=O 鍵能/(kJ?mol-1) 358 347 614 745 (填字母,下同);在堿性條件下發(fā)生取代反應(yīng)(即水解反應(yīng)時(shí)),最易斷裂的化學(xué)鍵為。
a.C-O
b.C-C
c.C=C
d.C=O
(2)由短周期元素組成的含有14個(gè)電子的四核化合物,其結(jié)構(gòu)式為;分子內(nèi)所含σ鍵的數(shù)目是,π鍵的數(shù)目是,σ鍵的強(qiáng)度比π鍵的強(qiáng)度,原因是。
(3)X、Y、Z是元素周期表中的短周期元素,其中X、Y同周期,Y Z同主族,Y原子最外層p軌道上的電子數(shù)等于前一電子層電子總數(shù),X原子最外層的p能級(jí)中只有一個(gè)軌道填充了2個(gè)電子,而且這三種元素可以形成化合物YX2、ZX2。根據(jù)上述信息回答下列問(wèn)題:
①寫(xiě)出下列元素符號(hào):X,Y,Z。
②YX2分子中含個(gè)σ鍵,含個(gè)π鍵。發(fā)布:2024/12/30 18:30:1組卷:13引用:2難度:0.8439.金屬及其化合物在生產(chǎn)生活等各個(gè)領(lǐng)域有著廣泛的應(yīng)用。
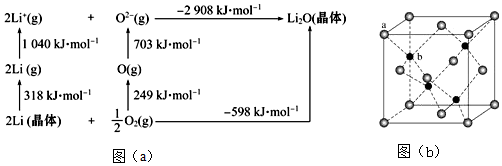
(1)鈦具有良好的金屬性能。鈦基態(tài)原子中電子占據(jù)能級(jí)個(gè)數(shù)為。與鈦同周期的元素中,基態(tài)原子的未成對(duì)電子數(shù)與鈦相同的還有種。鈦比鋼輕、比鋁硬,是一種新興的結(jié)構(gòu)材料,鈦硬度比鋁大的可能原因是。
(2)有一種氮化鈦晶體的晶胞與NaCl晶胞相似,該晶胞中N、Ti之間的最近距離為a×10-10cm,則該氮化鈦的密度為g?cm-3(NA為阿伏加德羅常數(shù)的值,只列計(jì)算式)。
(3)Li是最輕的固體金屬,采用Li作為負(fù)極材料的電池具有小而輕、能量密度大等優(yōu)良性能,得到廣泛應(yīng)用。Li2O是離子晶體,其晶格能可通過(guò)圖(a)的Bom-Haber循環(huán)計(jì)算得到。
Li原子的第一電離能為kJ?mol-1,O═O鍵鍵能為kJ?mol-1,Li2O晶格能為kJ?mol-1。
(4)Zn可形成多種化合物,其中立方ZnS晶胞結(jié)構(gòu)如圖(b),其陰離子(S2-)按面心立方密堆積排布,立方ZnS的配位數(shù)與NaCl不同,這是由因素決定的。發(fā)布:2024/12/30 18:30:1組卷:7引用:2難度:0.7440.下列有關(guān)敘述錯(cuò)誤的是( )
A.COCl2分子的結(jié)構(gòu)式: 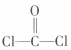
B.HBr分子的電子式: 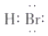
C.乙炔分子中的共價(jià)鍵由3個(gè)σ鍵和2個(gè)π鍵組成 D.H原子和O原子既可以形成H2O分子,也可以形成H2O2分子,這與共價(jià)鍵的飽和性相矛盾 發(fā)布:2024/12/30 18:30:1組卷:11引用:4難度:0.8



