某小組同學將一定量的稀硫酸滴加到盛有NaOH溶液的小燒杯中,實驗中未觀察到明顯現象,請教老師后,發現他們在滴加稀硫酸前忘了加入酸堿指示劑,導致無法判斷反應情況,于是他們對試管中溶液的中和程度進行探究。該反應的化學方程式為 2NaOH+H2SO4=Na2SO4+2H2O2NaOH+H2SO4=Na2SO4+2H2O。針對反應后溶液中溶質是什么,大家紛紛提出猜想:
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
實驗探究:
(1)小雷同學取燒杯中的溶液少量于試管中,滴加幾滴CuSO4溶液,無明顯變化,溶液中一定沒有 NaOHNaOH。
(2)為了驗證其余猜想,小組其他同學利用燒杯中的溶液,并選用老師提供的pH試紙、BaCl2溶液、Na2CO3溶液,進行如下三個方案的探究。
| 實驗方案 | 測溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 實驗操作 | 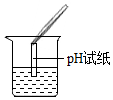 |
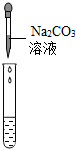 |
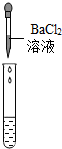 |
| 實驗現象 | 試紙變色,對比比色卡,pH<7 |
有氣泡產生 有氣泡產生
|
產生白色沉淀 |
| 實驗結論 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
評價反思:
老師對同學們能用多種方法進行探究,并且得出正確結論給予肯定。同時指出實驗探究(2)中存在兩處明顯錯誤,請大家反思。同學們經過反思發現了這兩處錯誤:①實驗操作中的錯誤是
pH試紙直接插入待測液
pH試紙直接插入待測液
。②實驗方案中也有一個是錯誤的,錯誤的原因是 硫酸鈉與氯化鋇反應也能產生硫酸鋇白色沉淀
硫酸鈉與氯化鋇反應也能產生硫酸鋇白色沉淀
。繼續探究:
請你再設計一個方案證明猜想二正確,方案是(“實驗步驟”中選擇的藥品不可以用酸堿指示劑,不可與上述實驗方案中藥品類別重復,“結論”的表述中能用化學方程式表示的要寫出化學方程式):
| 步驟 | 現象 | 結論 |
|
取少量反應后的溶液,加入氧化銅 取少量反應后的溶液,加入氧化銅
|
黑色固體溶解,形成藍色溶液 黑色固體溶解,形成藍色溶液
|
CuO+H2SO4=CuSO4+H2O CuO+H2SO4=CuSO4+H2O
|
【答案】2NaOH+H2SO4=Na2SO4+2H2O;NaOH;有氣泡產生;pH試紙直接插入待測液;硫酸鈉與氯化鋇反應也能產生硫酸鋇白色沉淀;取少量反應后的溶液,加入氧化銅;黑色固體溶解,形成藍色溶液;CuO+H2SO4=CuSO4+H2O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:234引用:1難度:0.6
相似題
-
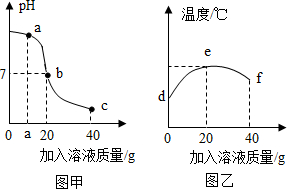 1.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )
1.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )A.當加入20g氫氧化鈉溶液時恰好完全反應 B.a點時溶液中的溶質為氫氧化鈉和氯化鈉 C.溫度上升是由于中和反應放熱,溫度下降是因為增加液體 D.e點時溶液中的溶質為氯化鈉 發布:2024/12/25 17:0:2組卷:71引用:3難度:0.6 -
 2.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )
2.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )A.無色 B.紅色 C.紫色 D.藍色 發布:2024/12/25 17:0:2組卷:68引用:3難度:0.9 -
3.某研究性學習小組為了探究氫氧化鈉溶液與稀硫酸是否恰好完全反應,分別取少量反應后的溶液于試管中,用下表中的不同試劑進行實驗.下列選項正確的是( )
選項 所用試劑 現象和結論 A 硫酸銅溶液 出現藍色沉淀,則氫氧化鈉過量 B 氯化鋇溶液 出現白色沉淀,則硫酸過量 C 銅絲 有氣泡產生,則硫酸過量 D 無色酚酞溶液 溶液不變色,則恰好完全反應 A.A B.B C.C D.D 發布:2024/12/25 17:30:2組卷:46引用:2難度:0.7


