我國向世界鄭重承諾力爭在2030年前實現(xiàn)碳達峰,在2060年前實現(xiàn)碳中和。在實現(xiàn)碳達峰和碳中和的過程中化學(xué)發(fā)揮著重要的作用。
(1)以TiO2為催化劑的光熱化學(xué)循環(huán)分解CO2的反應(yīng):2CO2(g)=2CO(g)+O2(g),為溫室氣體減排提供了一個新途徑,該反應(yīng)轉(zhuǎn)化過程及各分子化學(xué)鍵完全斷裂時的能量變化如圖所示:
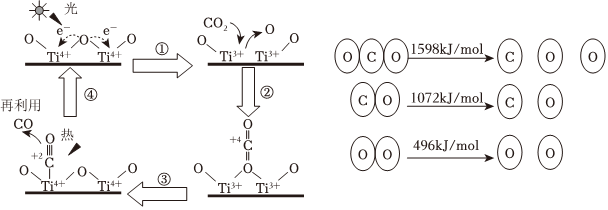
①根據(jù)數(shù)據(jù)計算,2CO2(g)=2CO(g)+O2(g)反應(yīng)2molCO2會 吸收吸收(填“吸收”或“放出”) 556556kJ的能量。
②下列關(guān)于反應(yīng)轉(zhuǎn)化過程說法錯誤的是 BB(填字母)。
A.反應(yīng)①中鈦氧鍵斷裂會吸收能量
B.該反應(yīng)中,光能轉(zhuǎn)化為化學(xué)能,化學(xué)能轉(zhuǎn)化為熱能
C.該過程中發(fā)生了電子的轉(zhuǎn)移
D.催化劑TiO2參與了反應(yīng)轉(zhuǎn)化過程
③將一氧化碳與氧氣的反應(yīng)設(shè)計成燃料電池,工作原理如圖所示,該裝置中電解質(zhì)為氧化釔-氧化鈉,其中O2-可以在固體介質(zhì)NASICON中自由移動。

工作時,負極電極反應(yīng)式 CO-2e-+O2-=CO2CO-2e-+O2-=CO2,CO燃料電池能量的利用率比CO直接燃燒的能量的利用率 高高(填“高”、“低”或“相同”)。
(2)新能源的使用有利于實現(xiàn)碳中和。氫氣是理想的新能源,可由天然氣和水反應(yīng)制備,其主要反應(yīng)為CH4(g)+2H2O(g)?CO2(g)+4H2(g),某溫度下,在10L恒容密閉容器中充入2molCH4(g)和3molH2O(g)制備氫氣,反應(yīng)中CH4(g)的物質(zhì)的量變化如圖所示。
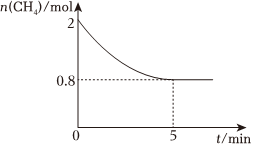
①5min前,CH4的轉(zhuǎn)化率逐漸 增大增大(填“增大”、“減小”或“不變”)。
②0~5min內(nèi),以H2(g)的濃度變化表示該反應(yīng)的平均速率為 0.096mol/(L?min)0.096mol/(L?min),5min時,混合氣體中H2的體積分數(shù)為 64.964.9%(精確到0.1%)。
【考點】反應(yīng)熱和焓變;化學(xué)平衡的計算.
【答案】吸收;556;B;CO-2e-+O2-=CO2;高;增大;0.096mol/(L?min);64.9
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:10引用:1難度:0.5
相似題
-
1.下列與化學(xué)反應(yīng)的能量變化有關(guān)的敘述正確的是( )
A.由石墨比金剛石穩(wěn)定可知,C(金剛石)═C(石墨)△H<0 B.一個反應(yīng)的反應(yīng)物的總能量可能等于其生成物的總能量 C.有熱量變化的反應(yīng)一定是化學(xué)反應(yīng) D.強酸與強堿的中和反應(yīng)的熱化學(xué)方程式均可表示為H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 發(fā)布:2025/1/6 6:0:5組卷:1引用:3難度:0.6 -
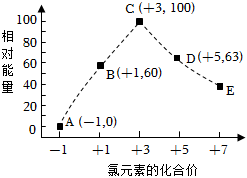 2.一定條件下,在水溶液中物質(zhì)的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩(wěn)定的點為( )
2.一定條件下,在水溶液中物質(zhì)的量均為1mol的Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相對大小如圖所示。圖中最穩(wěn)定的點為( )A.A B.B C.C D.D 發(fā)布:2025/1/6 6:0:5組卷:0引用:1難度:0.9 -
3.下列說法不正確的是( )
A.CH3COOH 溶液加水稀釋后,溶液中 的值減小c(CH3COOH)c(CH3COO-)B.已知一定溫度下,醋酸溶液的物質(zhì)的量濃度為c,電離度為α,Ka= .若加入少量醋酸鈉固體,則CH3COOH?CH3COO-+H+向左移動,α減小,Ka變小(cα)2c(1-α)C.實驗測得環(huán)己烷(l)、環(huán)己烯(l)和苯(l)的標準燃燒熱分別為-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以證明在苯分子中不存在獨立的碳碳雙鍵 D.已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol.
CO(g)+O2(g)═CO2(g),△H=-283.0 kJ/mol.12
C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol.
則4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol發(fā)布:2025/1/1 8:0:2組卷:11引用:1難度:0.7
相關(guān)試卷


