我國近代化學工業(yè)的奠基人之一侯德榜發(fā)明的“侯氏制堿法”,將制堿技術發(fā)展到了一個新的水平,在此基礎上,將工業(yè)純堿(含Mg2+、Fe3+、Cl-等雜質)進行提純。工藝流程如圖。
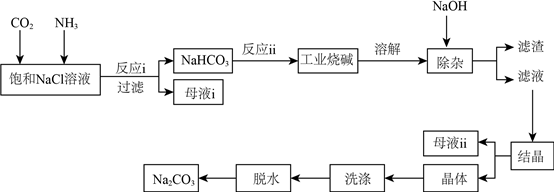
已知NaHCO3在低溫下溶解度較小。
(1)反應Ⅰ的化學方程式為 NaCl+H2O+CO2+NH3═NH4Cl+NaHCO3↓NaCl+H2O+CO2+NH3═NH4Cl+NaHCO3↓。
(2)母液Ⅰ中主要含有 NH4ClNH4Cl(填化學式),寫出該物質的一種常見用途 作氮肥、制造其它銨鹽、金屬焊接助熔劑等作氮肥、制造其它銨鹽、金屬焊接助熔劑等。
(3)流程中加入NaOH除去的雜質離子是 Mg2+、Fe3+Mg2+、Fe3+。
(4)結晶后的Na2CO3晶體表面附著有NaCl等雜質,需洗滌除去。檢驗NaCl是否已被洗滌除盡,需進行的操作和現(xiàn)象是 取最后一次洗滌液于試管中,加入足量稀硝酸酸化,再加入2~3滴AgNO3溶液,若無沉淀產(chǎn)生,說明Cl-已除盡,反之,未除盡取最后一次洗滌液于試管中,加入足量稀硝酸酸化,再加入2~3滴AgNO3溶液,若無沉淀產(chǎn)生,說明Cl-已除盡,反之,未除盡,相關反應的離子方程式是 Ag++Cl-═AgCl↓、2H++CO2-3═H2O+CO2↑Ag++Cl-═AgCl↓、2H++CO2-3═H2O+CO2↑。
CO
2
-
3
CO
2
-
3
【考點】純堿工業(yè)(侯氏制堿法).
【答案】NaCl+H2O+CO2+NH3═NH4Cl+NaHCO3↓;NH4Cl;作氮肥、制造其它銨鹽、金屬焊接助熔劑等;Mg2+、Fe3+;取最后一次洗滌液于試管中,加入足量稀硝酸酸化,再加入2~3滴AgNO3溶液,若無沉淀產(chǎn)生,說明Cl-已除盡,反之,未除盡;Ag++Cl-═AgCl↓、2H++═H2O+CO2↑
CO
2
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/10/16 1:0:1組卷:36引用:2難度:0.7
相似題
-
1.以NaCl為原料,可制取純堿。Na2CO3可用侯氏制堿法制取,主要涉及如下反應:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有關實驗室模擬侯氏制堿法的實驗原理和裝置正確的是( )△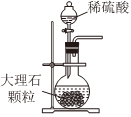
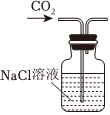
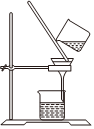
A.制取CO2 B.制取NaHCO3 C.分離NaHCO3 D.制取Na2CO3 A.A B.B C.C D.D 發(fā)布:2024/12/8 18:0:1組卷:165引用:5難度:0.8 -
2.“侯氏制堿法”的主要過程如圖(部分物質已略去)。
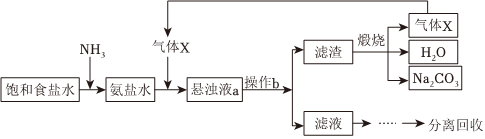
下列說法錯誤的是( )A.氣體X為CO2 B.操作b為過濾 C.懸濁液a中的不溶物主要是NH4Cl D.氨鹽水中通入氣體X后,溶液中Na+大量減少 發(fā)布:2024/12/8 0:0:1組卷:133引用:4難度:0.7 -
3.氨堿法(索氏)和聯(lián)合制堿法(侯氏)是兩大重要的工業(yè)制堿法,下列表達正確的是( )
氨堿法 聯(lián)合制堿法 A 原料 食鹽、氨氣、生石灰 食鹽、氨氣、二氧化碳 B 副產(chǎn)物 氯化鈣 氯化銨 C 循環(huán)物質 氨氣、二氧化碳 氯化鈉 D 評價 原料易得、設備簡單、能耗低 原料利用率高、廢棄物少 A.A B.B C.C D.D 發(fā)布:2024/12/16 6:0:1組卷:38引用:2難度:0.8


