小明和興趣小組同學利用鐵與硫酸銅溶液反應,比較鐵與銅的活動性強弱,發現鐵絲表面有紅色物質析出,溶液顏色由藍色逐漸變為淺綠色,但有時會出現溶液顏色變為淡黃綠色或淡藍色,甚至無明顯變化的異常現象。
(1)針對上述異常現象,他們認為可能是溶液濃度或反應時間不同導致。為進一步探究此問題,請你設計實驗方案并寫出實驗步驟 ①將質量分數為16%的硫酸銅溶液稀釋成4%、8%、12%的硫酸銅溶液備用;②取四支試管分別裝入5mL4%、8%、12%、16%的硫酸銅溶液,然后在相同實驗條件下,將4根大小相同的鐵絲同時放入4支試管內;③在20分鐘內觀察試管內溶液顏色變化,每2分鐘記錄一次顏色變化情況;④比較不同濃度的硫酸銅溶液,在相同時間內溶液的顏色變化,同時比較同一濃度硫酸銅溶液在不同時間的顏色變化,得出溶液濃度和反應時間對溶液顏色變化的影響。①將質量分數為16%的硫酸銅溶液稀釋成4%、8%、12%的硫酸銅溶液備用;②取四支試管分別裝入5mL4%、8%、12%、16%的硫酸銅溶液,然后在相同實驗條件下,將4根大小相同的鐵絲同時放入4支試管內;③在20分鐘內觀察試管內溶液顏色變化,每2分鐘記錄一次顏色變化情況;④比較不同濃度的硫酸銅溶液,在相同時間內溶液的顏色變化,同時比較同一濃度硫酸銅溶液在不同時間的顏色變化,得出溶液濃度和反應時間對溶液顏色變化的影響。。
建議:①實驗可設計4~5組;②實驗時每支試管取用硫酸銅溶液5毫升;③每次實驗總時間為20分鐘。實驗室提供鐵絲、質量分數為16%的硫酸銅溶液、蒸餾水及其它實驗所需的儀器。
(2)列舉一個因反應物濃度不同導致實驗現象不同的例子,寫出反應物及現象 鐵在空氣中無法點燃,鐵在氧氣中劇烈燃燒,火星四射,生成黑色固體,并放出熱量鐵在空氣中無法點燃,鐵在氧氣中劇烈燃燒,火星四射,生成黑色固體,并放出熱量。
【考點】金屬活動性順序及其應用.
【答案】①將質量分數為16%的硫酸銅溶液稀釋成4%、8%、12%的硫酸銅溶液備用;②取四支試管分別裝入5mL4%、8%、12%、16%的硫酸銅溶液,然后在相同實驗條件下,將4根大小相同的鐵絲同時放入4支試管內;③在20分鐘內觀察試管內溶液顏色變化,每2分鐘記錄一次顏色變化情況;④比較不同濃度的硫酸銅溶液,在相同時間內溶液的顏色變化,同時比較同一濃度硫酸銅溶液在不同時間的顏色變化,得出溶液濃度和反應時間對溶液顏色變化的影響。;鐵在空氣中無法點燃,鐵在氧氣中劇烈燃燒,火星四射,生成黑色固體,并放出熱量
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:109引用:5難度:0.5
相似題
-
 1.小金分別將鋅、氫氧化鈉、硝酸銀等固體藥品加入到三支盛有稀鹽酸的試管中。如圖為加入某固體后,溶液中主要離子種類及個數比變化的微觀示意圖,不考慮離子的大小關系,則“
1.小金分別將鋅、氫氧化鈉、硝酸銀等固體藥品加入到三支盛有稀鹽酸的試管中。如圖為加入某固體后,溶液中主要離子種類及個數比變化的微觀示意圖,不考慮離子的大小關系,則“ ”表示 (填離子符號),加入的固體可以是(選填“鋅”或“氫氧化鈉”或“硝酸銀”)。發布:2024/12/28 16:0:2組卷:54引用:3難度:0.5
”表示 (填離子符號),加入的固體可以是(選填“鋅”或“氫氧化鈉”或“硝酸銀”)。發布:2024/12/28 16:0:2組卷:54引用:3難度:0.5 -
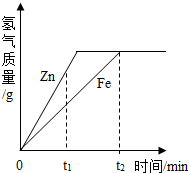 2.一定質量的鋅、鐵分別和等量的鹽酸反應,產生氫氣質量與時間的關系如圖所示,下列說法不正確的是( )
2.一定質量的鋅、鐵分別和等量的鹽酸反應,產生氫氣質量與時間的關系如圖所示,下列說法不正確的是( )A.t1時,產生氫氣的質量鋅比鐵大 B.t1時,產生氫氣的速率鋅比鐵大 C.t2時,參加反應鋅的質量與鐵相同 D.t2時,鋅、鐵消耗的鹽酸質量相同 發布:2024/12/28 16:30:2組卷:55引用:5難度:0.5 -
3.小明在學習金屬活動性順序后,知道鉀、鈣、鈉金屬活動性特別強,能與水反應生成堿和氫氣,他想鎂緊排在鈉后面,它是否也能與水反應呢?
【提出問題】鎂是否能與水反應?
【實驗探究】在兩個燒杯中,分別加入等量的冷水和鎂條,用酚酞作指示劑,實驗過程和現象如圖:
【反思與總結】
(1)小明得出的實驗結論是;
(2)小明發現B試管放置在空氣中一會兒,溶液的紅色會褪色,這說明溶液的堿性減弱了,于是他大膽作出了一個猜想并設計了驗證方案:
小明通過實驗證明了自己的猜想是正確的。猜想 驗證方案 可能是氫氧化鎂的溶解度受溫度的影響,溫度降低,溶解度變小,從而導致溶液堿性減弱 將褪色后的溶液 ,如果溶液變紅,說明小明的猜想正確
(3)一段時間后,小明觀察到鎂條在熱水中無現象,但當他想到實驗室制取二氧化碳不能用稀硫酸與大理石反應時,便有了解釋,他的解釋是。發布:2024/12/28 16:0:2組卷:7引用:2難度:0.5


