化學實驗是研究物質組成和探究物質性質的重要途徑。
Ⅰ.某澄清透明溶液(忽略水的電離),可能含有Fe3+、Mg2+、K+、CO32-、SO42-、Ba2+、MnO4-等離子中的幾種,且離子的物質的量相等(即離子數目相等),為分析其成分,取此溶液分別進行了三個實驗,其操作和有關現象如圖所示:
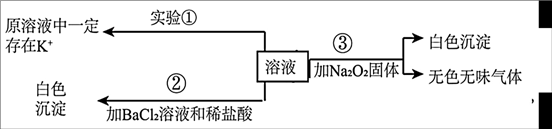
請你根據上述實驗推斷:
(1)實驗③產生的無色無味氣體為 O2O2、白色沉淀為 Mg(OH)2Mg(OH)2。(填物質化學式)
(2)原溶液中一定存在的離子有 Mg2+、K+、SO42-、MnO4-Mg2+、K+、SO42-、MnO4-,一定不存在的離子有 Fe3+、CO32-、Ba2+Fe3+、CO32-、Ba2+。
(3)向該溶液中加入硫酸酸化,再通入SO2氣體,發生反應使該溶液的顏色發生變化,寫出該反應的離子方程式(已知該反應中氧化劑和還原劑的個數比為2:5):2H2O+2MnO4-+5SO2=2Mn2++5SO42-+4H+2H2O+2MnO4-+5SO2=2Mn2++5SO42-+4H+。
Ⅱ.Na2O2具有強氧化性,H2具有還原性,某同學根據氧化還原反應的知識推測Na2O2與H2能發生反應。為了驗證此推測結果,該同學設計并進行了如圖所示實驗。其中裝置A中用鋅和稀鹽酸制取氫氣。
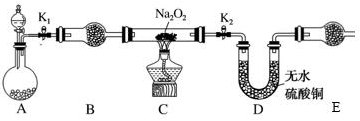
(4)裝置B的名稱 球形干燥管球形干燥管,作用是 干燥氫氣干燥氫氣。
(5)下面是實驗過程中的重要操作,正確的順序是 CBADCBAD。
A.加熱至Na2O2逐漸熔化,反應一段時間
B.用小試管收集氣體并檢驗其純度
C.打開K1、K2,通入氫氣
D.停止加熱,充分冷卻,關閉K1、K2
(6)實驗過程中觀察到淡黃色粉末慢慢變成白色固體,無水硫酸銅未變藍色。由此可推測出Na2O2與H2反應生成的產物為 NaOHNaOH。
【考點】常見離子的檢驗方法.
【答案】O2;Mg(OH)2;Mg2+、K+、SO42-、MnO4-;Fe3+、CO32-、Ba2+;2H2O+2MnO4-+5SO2=2Mn2++5SO42-+4H+;球形干燥管;干燥氫氣;CBAD;NaOH
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:25引用:1難度:0.7
相似題
-
1.某無色溶液,其中可能存在Na+、Ba2+、
、S2-、AlO-2、SO2-3.取該溶液進行有關實驗,實驗結果如圖所示.SO2-4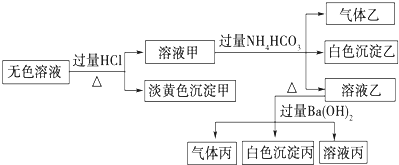
回答下列問題:
(1)沉淀甲的化學式為.
(2)由溶液甲生成沉淀乙的離子方程式為.
(3)沉淀丙中一定含有(填化學式,下同),可能含有.
(4)綜合上述信息,該溶液中肯定存在的離子有.
(5)該溶液顯性(填酸性、堿性或中性),若要檢驗其酸堿性,下圖操作正確的是.
請用離子方程式表示顯堿性的原因:.發布:2024/12/30 6:0:2組卷:10引用:2難度:0.3 -
2.在實驗室鑒定氯酸鉀晶體和1-氯丙烷中的氯元素,現設計了下列實驗操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加熱;④加催化劑MnO2;⑤加蒸餾水過濾后取濾液;⑥過濾后取殘渣;⑦用HNO3酸化。(填序號)
(1)鑒定氯酸鉀中氯元素的操作步驟依次是
(2)鑒定1-氯丙烷中氯元素的操作步驟依次是。發布:2024/12/30 8:0:15組卷:67引用:8難度:0.5 -
3.為檢驗某種陽離子為Na-的溶液中含有的陰離子是SO42-、CO32-、OH-還是Cl-,下列設計的方案合理的是( )
A.檢驗CO32-:向待測液中加入足量的鹽酸產生氣泡,將氣體通入濃Ba(OH)2溶液中有白色沉淀生成 B.檢驗SO42-:先向待測液中加入鹽酸至溶液呈酸性,未見沉淀或氣體生成,再加入BaCl2溶液出現白色沉淀 C.檢驗OH-:向待測液中加入石蕊溶液,溶液變紅 D.檢驗Cl-:向待測液中依次加入AgNO3溶液和稀鹽酸,有白色渾濁出現 發布:2024/12/30 6:30:2組卷:9引用:2難度:0.6


