金屬在生產生活中發揮著重要的作用。小組同學圍繞金屬銅展開了學習。
Ⅰ:銅的性質
小組同學通過如圖所示實驗認識銅的性質:
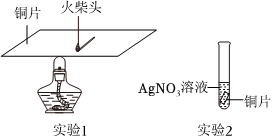
(1)實驗1,觀察到火柴頭燃燒,說明銅具有的物理性質是 導熱性導熱性。
(2)實驗2的現象是 銅片表面有銀白色固體析出,溶液由無色變為藍色銅片表面有銀白色固體析出,溶液由無色變為藍色。
Ⅱ:銅的冶煉
銅是人類最早使用的金屬之一,煉銅工藝的發展史如圖所示。
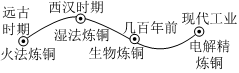
(3)火法煉銅涉及的化學反應之一為:Cu2(OH)2CO3加熱 2CuO+H2O+CO2↑,該反應是 分解反應分解反應。(填基本反應類型)
(4)北宋沈括所著的《夢溪筆談》中記載了“濕法煉銅”的方法:“熬膽礬鐵釜,久之亦化為銅”。即在硫酸銅溶液中加入鐵,則可得到銅。該反應的化學方程式是 Fe+CuSO4=FeSO4+CuFe+CuSO4=FeSO4+Cu。
(5)生物煉銅是先將硫化銅(CuS)在硫桿菌的作用下與空氣中的 氧氣或O2氧氣或O2化合生成硫酸銅。
(6)電解精煉銅過程中,電能轉化為 化學化學能。
(7)我國古代制黃銅的原理如圖所示。
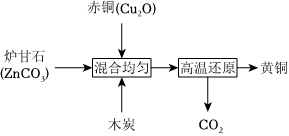
①混合均勻前常將爐甘石、木炭等原料粉碎,其目的是 增大反應物接觸面積,使其充分反應增大反應物接觸面積,使其充分反應。
②高溫還原過程中涉及的主要反應有C+2Cu2O高溫 4Cu+CO2↑,得到的黃銅比純銅硬度 大大(填“大”或“小”)。
③為了測定某黃銅中銅的質量分數,取10g黃銅粉末加入足量稀硫酸,產生氫氣0.1g。則該混合物中銅的質量分數為 67.5%67.5%。
Ⅲ:銅的銹蝕
銅銹賦予青銅器歷史感。銅銹主要有Cu2(OH)2CO3和Cu2(OH)3Cl,考古界根據銅銹是否會加速銅的銹蝕分為“有害銹”和“無害銹”,其作用示意圖如下:
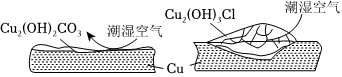
(8)據圖可知Cu2(OH)3Cl具有 疏松疏松(填“致密”或“疏松”)結構,因此屬于 有害銹有害銹(填“有害銹”或“無害銹”)。
加熱
高溫
【答案】導熱性;銅片表面有銀白色固體析出,溶液由無色變為藍色;分解反應;Fe+CuSO4=FeSO4+Cu;氧氣或O2;化學;增大反應物接觸面積,使其充分反應;大;67.5%;疏松;有害銹
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/5/31 8:0:9組卷:73引用:2難度:0.4
相似題
-
1.生物浸出技術在金屬冶煉中應用廣泛.嗜熱細菌在65~80℃酸性水溶液及氧氣存在等條件下,能氧化黃銅礦(主要成分CuFeS2)產生硫酸鹽,進而生產銅和硫酸亞鐵,主要流程如圖(“…”表示省略的部分流程):
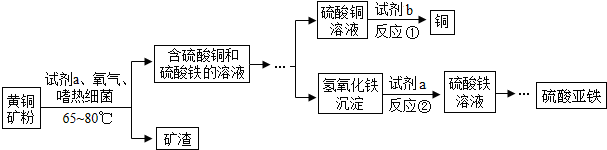
有以下說法:(1)分離出礦渣的操作是過濾;(2)試劑b只能是鐵粉;(3)反應②是復分解反應;(4)試劑a是稀硫酸;(5)鐵元素在整個流程中都以Fe2+存在.
其中錯誤的是( )A.(1)(2) B.(2)(3) C.(4)(5) D.(2)(5) 發布:2024/12/19 8:0:1組卷:181引用:2難度:0.7 -
2.鈦合金有良好的耐熱強度、低溫韌性。生產金屬鈦的步驟主要有:
①在高溫下,向金紅石(含TiO2)與焦炭的混合物中通入氯氣,得到TiCl4和一種可燃性氣體;
②在稀有氣體環境和加熱條件下,用Mg與TiCl4反應得到Ti和MgCl2。
下列說法不正確的是( )A.①中的反應為TiO2+2C+2C12 TiCl4+2CO高溫B.反應②中稀有氣體的作用是防止Mg與空氣反應 C.可用反應①產生的氣體冶煉金屬 D.反應①、②中的鈦元素化合價未發生改變 發布:2024/12/25 11:30:2組卷:401引用:4難度:0.8 -
3.高鐵列車車體使用了含鎳不銹鋼,火法煉鎳的原理是2X+C
2Ni+CO2↑,下列說法錯誤的是( )高溫A.反應后Ni的化合價降低了 B.不銹鋼是鐵的一種合金 C.X的化學式是NiO D.該反應屬于復分解反應 發布:2024/12/25 15:0:2組卷:7引用:3難度:0.5


