如圖中的實線表示元素周期表的邊界。①~⑧分別表示元素周期表中對應(yīng)位置的元素。

(1)①的單質(zhì)性質(zhì)較穩(wěn)定,原因是 氮?dú)夥肿觾?nèi)存在氮氮三鍵,共價鍵的鍵能很大,不易斷裂,所以氮?dú)庑再|(zhì)穩(wěn)定氮?dú)夥肿觾?nèi)存在氮氮三鍵,共價鍵的鍵能很大,不易斷裂,所以氮?dú)庑再|(zhì)穩(wěn)定。
(2)在上面的元素周期表中通常尋找催化劑材料的區(qū)域,用斜線陰影標(biāo)明 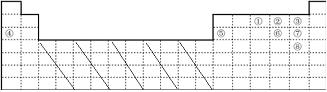
 。
。
(3)上述元素所能形成的簡單離子中半徑最小的是 Al3+Al3+(填離子符號),最高價氧化物對應(yīng)水化物酸性最強(qiáng)的是 HClO4HClO4(填分子式)。
(4)用電子式表示④與⑥形成化合物的過程 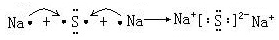
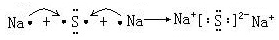 。
。
(5)元素①的氫化物結(jié)構(gòu)式為 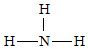
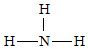 ,屬于 分子分子晶體,其空間構(gòu)型是 三角錐形三角錐形。
,屬于 分子分子晶體,其空間構(gòu)型是 三角錐形三角錐形。
(6)⑤、⑦各自的最高價氧化物對應(yīng)的水化物可以反應(yīng)生鹽和水,該反應(yīng)的離子方程式為 3H++Al(OH)3=Al3++3H2O3H++Al(OH)3=Al3++3H2O。
(7)有人認(rèn)為周期表中,位于ⅠA族的氫元素,也可放在ⅦA族,下列物質(zhì)能支持這種觀點(diǎn)的是 CC。
A.HF
B.H3O+
C.NaH
D.H2O2
(8)硒(se)是人體必需的微量元素,與②同一主族,Se原子比②原子多兩個電子層,其最高價氧化物對應(yīng)的水化物化學(xué)式為 H2SeO4H2SeO4。該族2~5周期元素單質(zhì)分別與H2反應(yīng)生成lmol氣態(tài)氫化物的反應(yīng)熱如下,表示生成1mol硒化氫反應(yīng)熱的是 cc(填字母代號)。
a.-99.7mol
b.-29.7mol
c.+20.6mol
d.+241.8kJ


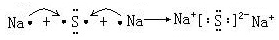
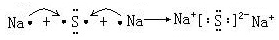
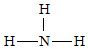
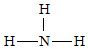
【答案】氮?dú)夥肿觾?nèi)存在氮氮三鍵,共價鍵的鍵能很大,不易斷裂,所以氮?dú)庑再|(zhì)穩(wěn)定; ;Al3+;HClO4;
;Al3+;HClO4;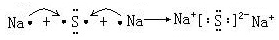 ;
;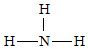 ;分子;三角錐形;3H++Al(OH)3=Al3++3H2O;C;H2SeO4;c
;分子;三角錐形;3H++Al(OH)3=Al3++3H2O;C;H2SeO4;c
 ;Al3+;HClO4;
;Al3+;HClO4;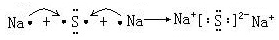 ;
;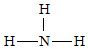 ;分子;三角錐形;3H++Al(OH)3=Al3++3H2O;C;H2SeO4;c
;分子;三角錐形;3H++Al(OH)3=Al3++3H2O;C;H2SeO4;c【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:6引用:1難度:0.7
相似題
-
 1.下表是元素周期表的一部分.表中所列的字母分別代表一種化學(xué)元素.
1.下表是元素周期表的一部分.表中所列的字母分別代表一種化學(xué)元素.
(1)元素a和元素b的簡單氫化物熔點(diǎn)較高的是a b c d e f (用化學(xué)式填空),其原因是.
(2)a和d可形成不同晶體,下列說法正確的是(NA是阿伏加德羅常數(shù)).
A.元素a的單質(zhì)可能是原子晶體或分子晶體
B.mg d元素形成的晶體中,含共價鍵數(shù)目為m NA/7
C.元素a與元素d形成的化合物40g,含NA個分子
D.元素d的最高價氧化物6g,含共價鍵物質(zhì)的量為0.4mol
(3)c和e形成的化合物的中,每個陽離子周圍距離最近且等距離的陽離子有個,一個晶胞中的陰離子數(shù)目為個.晶體中陽離子和陰離子核間距為a cm,該化合物相對分子質(zhì)量為M,NA為阿伏加德羅常數(shù),則晶體密度為g/cm3.
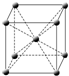
(4)f原子的外圍電子排布式為,其晶胞結(jié)構(gòu)如圖,f單質(zhì)的晶體密度為ρg/cm3,f相對原子質(zhì)量為M,阿伏加德羅常數(shù)NA,則f的原子半徑為.發(fā)布:2025/1/18 8:0:1組卷:8引用:1難度:0.3 -
2.甲~庚等元素在周期表中的相對位置如圖,己的最高氧化物對應(yīng)水化物有強(qiáng)脫水性,甲和丁在同一周期,甲原子最外層與最內(nèi)層具有相同電子數(shù).下列判斷正確的是( )
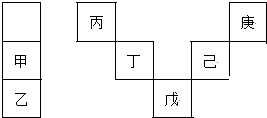
A.丁用于制造光導(dǎo)纖維 B.氣態(tài)氫化物的穩(wěn)定性:庚<己<戊 C.常溫下,甲和乙的單質(zhì)均能與水劇烈反應(yīng) D.丙與戊的原子序數(shù)相差28 發(fā)布:2024/12/30 19:30:2組卷:50引用:5難度:0.7 -
3.如圖為元素周期表短周期的一部分,下列有關(guān)A、B、C、D四種元素的敘述正確的是( )

A.原子半徑大小為:B>A>C B.核電荷數(shù):D>C>B>A C.A與D形成的化合物均是離子鍵 D.生成的氫化物的穩(wěn)定性為:D>A>B 發(fā)布:2024/12/30 18:30:1組卷:8引用:3難度:0.7
相關(guān)試卷


