Na2CO3和NaHCO3是中學(xué)化學(xué)中常見(jiàn)的物質(zhì),在生產(chǎn)生活中有重要的用途。
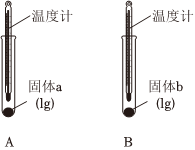
i.某小組同學(xué)依據(jù)性質(zhì)差異,采用比較的方法設(shè)計(jì)實(shí)驗(yàn)鑒別Na2CO3和NaHCO3。
| 實(shí)驗(yàn)Ⅰ | 實(shí)驗(yàn)Ⅱ |
 |
 |
放出
放出
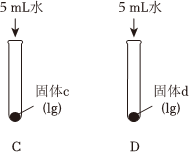
(填“放出”或“吸收”)熱量,可判斷固體b為Na2CO3。(2)實(shí)驗(yàn)Ⅱ中,向試管C和D中分別加入5mL水,充分振蕩,試管C中固體有剩余,試管D中固體完全溶解。判斷固體d為
Na2CO3
Na2CO3
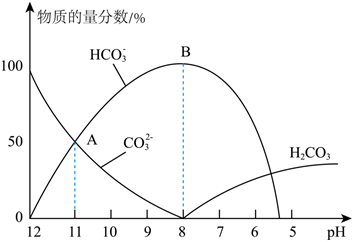
(填化學(xué)式)。(3)25℃時(shí),在10mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1HCl溶液,溶液的pH逐漸降低,此時(shí)溶液中含碳微粒的物質(zhì)的量分?jǐn)?shù)(某微粒x的物質(zhì)的量分?jǐn)?shù)=
c
(
x
)
c
(
H
2
C
O
3
)
+
c
(
HC
O
3
-
)
+
c
(
C
O
3
2
-
)
CO
2
-
3
HCO
-
3
CO
2
-
3
HCO
-
3
ii.實(shí)驗(yàn)室用Na2CO3固體配制500mL0.10mol/L的Na2CO3溶液,回答下列問(wèn)題:
(4)稱(chēng)量的Na2CO3固體質(zhì)量應(yīng)為
5.3
5.3
g。(5)實(shí)驗(yàn)操作的正確順序是
①②④⑤③
①②④⑤③
。(填序號(hào))①將稱(chēng)量好的Na2CO3中加適量蒸餾水溶解在小燒杯中。
②將①所得溶液冷卻到室溫后,小心轉(zhuǎn)入
500mL容量瓶
500mL容量瓶
(填儀器名稱(chēng))中。③將容量瓶瓶塞塞緊,充分搖勻。
④用少量蒸餾水洗滌燒杯和玻璃棒2~3次。
⑤繼續(xù)加蒸餾水至液面距刻度線(xiàn)1~2cm處,改用
膠頭滴管
膠頭滴管
(填儀器名稱(chēng)),小心滴加蒸餾水至溶液凹液面最低點(diǎn)與刻度線(xiàn)相切。(6)取出100mL配制好的溶液,加蒸餾水稀釋至c(Na2CO3)=0.02mol/L。則稀釋后溶液的體積為
500mL
500mL
。(7)下列操作會(huì)使所配溶液的物質(zhì)的量濃度偏低的是
ACD
ACD
。(填字母序號(hào))A.將燒杯中的溶液轉(zhuǎn)移到容量瓶時(shí)不慎灑到容量瓶外
B.定容時(shí),俯視容量瓶上的刻度線(xiàn)
C.加水定容時(shí),水量超過(guò)了刻度線(xiàn)
D.洗滌步驟中,洗滌液沒(méi)有轉(zhuǎn)入容量瓶
【考點(diǎn)】探究碳酸鈉與碳酸氫鈉的性質(zhì);配制一定物質(zhì)的量濃度的溶液.
【答案】放出;Na2CO3;+H+=;5.3;①②④⑤③;500mL容量瓶;膠頭滴管;500mL;ACD
CO
2
-
3
HCO
-
3
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:50引用:2難度:0.7
相似題
-
1.Ⅰ.某小組同學(xué)進(jìn)行Na2CO3和NaHCO3性質(zhì)的探究,實(shí)驗(yàn)如下(夾持裝置已略去,氣密性已檢驗(yàn))。
(1)實(shí)驗(yàn)Ⅰ,能夠證明Na2CO3的熱穩(wěn)定性強(qiáng)于NaHCO3的證據(jù)是實(shí)驗(yàn)Ⅰ 實(shí)驗(yàn)Ⅱ 
 。
。
(2)實(shí)驗(yàn)Ⅱ,方框中為洗氣裝置,請(qǐng)將該裝置補(bǔ)充完整。
(3)實(shí)驗(yàn)Ⅱ,試劑a為。
(4)實(shí)驗(yàn)Ⅱ,持續(xù)一段時(shí)間后,觀察到飽和Na2CO3溶液中有細(xì)小晶體析出,用化學(xué)方程式表示產(chǎn)生細(xì)小晶體的原因:。
Ⅱ.實(shí)驗(yàn)小組繼續(xù)利用傳感器探究Na2CO3和NaHCO3的性質(zhì)。
【查閱資料】pH越小,c(OH-)越小,溶液堿性越弱。
【實(shí)驗(yàn)過(guò)程】
【分析與解釋】編號(hào) 實(shí)驗(yàn)操作 實(shí)驗(yàn)數(shù)據(jù) 實(shí)驗(yàn)Ⅰ 測(cè)量下述實(shí)驗(yàn)過(guò)程的溫度變化 

實(shí)驗(yàn)Ⅱ 測(cè)量下述實(shí)驗(yàn)過(guò)程的pH變化 

(1)實(shí)驗(yàn)Ⅰ中,溶解時(shí)吸收熱量的物質(zhì)是。
(2)實(shí)驗(yàn)Ⅱ中,Na2CO3溶液和澄清石灰水反應(yīng)的離子方程式為,OH-未參與該反應(yīng)的實(shí)驗(yàn)證據(jù)是。
(3)實(shí)驗(yàn)Ⅱ中,滴加NaHCO3溶液的pH變化與滴加Na2CO3溶液的有明顯差異,原因是滴加NaHCO3溶液的燒杯中,參與反應(yīng)的離子有。發(fā)布:2024/10/16 0:0:1組卷:21引用:1難度:0.7 -
2.某小組同學(xué)依據(jù)性質(zhì)差異,采用比較的方法設(shè)計(jì)實(shí)驗(yàn)鑒別Na2CO3和NaHCO3。
(1)實(shí)驗(yàn)Ⅰ中,分別向兩支試管中滴加幾滴水,A中溫度計(jì)示數(shù)略有降低,B中溫度計(jì)示數(shù)升高。說(shuō)明固體b與水作用的過(guò)程中實(shí)驗(yàn)Ⅰ 實(shí)驗(yàn)Ⅱ 實(shí)驗(yàn)Ⅲ 

 (填“放出”或“吸收”)熱量,可判斷固體b為Na2CO3。
(填“放出”或“吸收”)熱量,可判斷固體b為Na2CO3。
(2)實(shí)驗(yàn)Ⅱ中,向試管C和D中分別加入5mL水,充分振蕩,試管C中固體有剩余,試管D中固體完全溶解。
①判斷固體d為。
②分別向兩支試管中滴加2滴酚酞,試管中紅色較淺。
(3)實(shí)驗(yàn)Ⅲ中,分別向溶液e和溶液f中逐滴加入稀鹽酸,F(xiàn)中開(kāi)始滴加就可以觀察到氣泡;E中開(kāi)始無(wú)氣泡產(chǎn)生,一段時(shí)間后產(chǎn)生氣泡。結(jié)合離子方程式解釋E中開(kāi)始無(wú)氣泡產(chǎn)生的原因。
(4)請(qǐng)你再設(shè)計(jì)一個(gè)鑒別Na2CO3和NaHCO3的實(shí)驗(yàn)方案:。發(fā)布:2024/11/16 9:30:1組卷:94引用:2難度:0.7 -
3.國(guó)際化學(xué)年的中國(guó)宣傳口號(hào)是“化學(xué)——我們的生活,我們的未來(lái)”。學(xué)習(xí)化學(xué)應(yīng)該明白“從生活中來(lái),到生活中去”道理。請(qǐng)?zhí)羁眨?br />(1)①若金屬鈉等活潑金屬著火時(shí),應(yīng)該用
來(lái)滅火。
②小蘇打可治療胃酸過(guò)多,其反應(yīng)的離子反應(yīng)方程式為:。
(2)火藥是中國(guó)的“四大發(fā)明”之一。黑火藥在發(fā)生爆炸時(shí),發(fā)生如下反應(yīng):2KNO3+3C+S═K2S+N2↑+3CO2↑其中被氧化的元素是,還原產(chǎn)物是。
(3)人體內(nèi)鐵元素是以Fe2+和Fe3+的形式存在。Fe2+易被人體吸收,服用維生素C,可使Fe3+轉(zhuǎn)化成Fe2+,有利于人體吸收,說(shuō)明維生素C具有(填“氧化性”或“還原性”)。
(4)探究碳酸氫鈉的熱穩(wěn)定性,并利用其產(chǎn)物驗(yàn)證過(guò)氧化鈉與二氧化碳的反應(yīng),按如圖裝置圖進(jìn)行實(shí)驗(yàn)。
①C中反應(yīng)的化學(xué)方程式為。
②E中收集的氣體主要是。
(5)請(qǐng)將5種物質(zhì):N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分別填入下面對(duì)應(yīng)的橫線(xiàn)上,組成一個(gè)已配平的化學(xué)方程式。
???+???→???+???+???+?H2O發(fā)布:2024/10/12 11:0:2組卷:49引用:1難度:0.7
相關(guān)試卷


