如圖所示為實驗室中常見氣體制備、凈化、干燥、收集和進行實驗探究的部分儀器(組裝實驗裝置時,可重復選擇儀器),化學小組的同學利用其進行下列化學實驗。
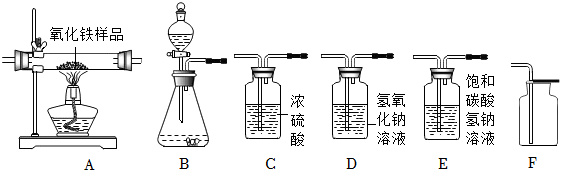
請根據題目要求,回答下列問題:
(1)以石灰石和稀鹽酸為原料,在實驗室中制備并收集一瓶干燥且不含HCl的二氧化碳氣體,按照要求設計實驗裝置,連接儀器,檢查裝置的氣密性,進行實驗。(提示:鹽酸中揮發出的少量HCl氣體可用飽和碳酸氫鈉溶液吸收)
①所選儀器的連接順序為 BECFBECF(從左到右填寫儀器序號字母)。
②上述方法制取二氧化碳的化學方程式為 CaCO3+2HCl=CaCl2+H2O+CO2↑CaCO3+2HCl=CaCl2+H2O+CO2↑。
③向一個收集滿二氧化碳氣體的集氣瓶中,同時放入一張干燥的藍色石蕊試紙和一張濕潤的藍色石蕊試紙,觀察到干燥的試紙不變色,而濕潤的試紙變紅。請敘述出現上述兩種不同現象的原因:二氧化碳不能使藍色石蕊試紙變紅,二氧化碳和水反應生成的碳酸有酸性,能使藍色石蕊試紙變紅二氧化碳不能使藍色石蕊試紙變紅,二氧化碳和水反應生成的碳酸有酸性,能使藍色石蕊試紙變紅
(2)化學小組的同學用一氧化碳氣體(含少量水蒸氣),測定某氧化鐵樣品(雜質為鐵粉)中Fe2O3的質量分數,設計了實驗方案,所選儀器按“CO(含少量水蒸氣)→C→A→D1→D2”的順序連接(D1、D2為氫氧化鈉洗氣瓶),檢查裝置的氣密性,然后進行實驗。(假設發生的化學反應都充分反應)
①該裝置中,洗氣瓶C的作用為 除去CO氣體中的水蒸氣除去CO氣體中的水蒸氣
②進行實驗時,檢查完裝置的氣密性,在儀器A硬質玻璃管中放入12g該氧化鐵樣品后,進行以下操作,其中應該先進行的是 bb(填選項序號之一)。
a.用酒精燈加熱
b.通入一氧化碳氣體(含少量水蒸氣)
③反應充分進行后冷卻,測得此時洗氣瓶C增重1.8g,洗氣瓶D1增重6.6g,則12g該氧化鐵樣品中Fe2O3的質量分數為 66.7%66.7%(計算結果精確至0.1%),該氧化鐵樣品中鐵元素與氧元素的質量比為 4:14:1(填最簡整數比)。
④從環保角度考慮,該套實驗裝置還存在明顯的不足之處,你的具體改進建議是 在裝置的末端加一個燃著的酒精燈在裝置的末端加一個燃著的酒精燈。
【答案】BECF;CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳不能使藍色石蕊試紙變紅,二氧化碳和水反應生成的碳酸有酸性,能使藍色石蕊試紙變紅;除去CO氣體中的水蒸氣;b;66.7%;4:1;在裝置的末端加一個燃著的酒精燈
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 8:0:9組卷:690引用:3難度:0.4
相似題
-
1.實驗室制取氣體所需的裝置如圖所示,請回答以下問題。
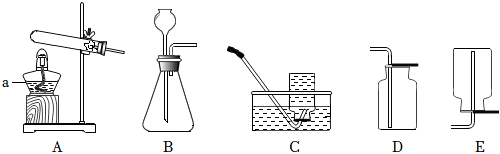
(1)a儀器名稱。收集氧氣可以選用C,原因是。用高錳酸鉀制氧氣,反應的化學方程式為。
(2)實驗室用石灰石和稀鹽酸制取CO2,發生裝置應選用,收集用,CO2的驗滿方法為。發布:2024/12/8 10:30:2組卷:50引用:4難度:0.5 -
2.用圖-1所示裝置制取干燥的CO2,并對CO2的部分性質進行探究。
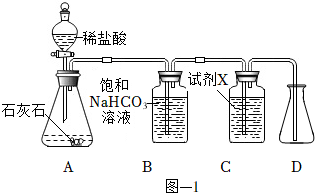
(1)裝置A中發生反應的化學方程式為。
(2)①裝置B中飽和NaHCO3溶液的作用是。
②裝置C中試劑X應該選用(填字母)。
a.稀H2SO4
b.濃H2SO4
c.KOH溶液
(3)收集CO2并驗滿。將集滿CO2的錐形瓶與盛有足量NaOH溶液的注射器和傳感器密封連接,緩慢的將NaOH溶液注入到錐形瓶中,采集信息形成圖像。見圖-2。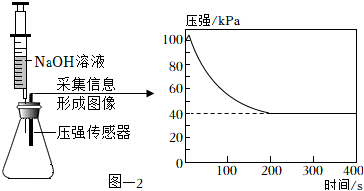
①檢驗裝置D中CO2已經集滿的方法是。
②隨著反應的進行,錐形瓶中壓強降低的原因是。
③反應結束后錐形瓶中的壓強保持在40kPa說明。
(4)取2mL飽和澄清石灰水于試管中,用4mL蒸餾水稀釋,向其中緩慢通入足量CO2。測定反應體系的電導率變化如圖-3所示。(忽略反應前后溶液體積的變化)
【查閱資料】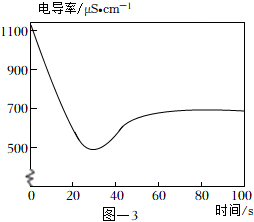
材料一:溶液的導電能力越強,溶液的電導率越大。
材料二:單位體積溶液中某離子的個數越多,則該離子的濃度越大,溶液的導電能力越強。相同濃度的不同離子導電能力不同。
材料三:Ca( OH)2溶于水能完全解離出Ca2+和OH-。
CaCO3遇到溶有CO2的水時,能反應生成易溶于水的Ca( HCO3)2,Ca( HCO3)2在水中能完全解離出Ca2+和。HCO-3
①石灰水中通入CO2氣體,溶液的電導率先逐漸降低的主要原因是。
②反應最終電導率的穩定值低于初始值的可能原因是、。發布:2024/12/25 13:0:1組卷:841引用:3難度:0.6 -
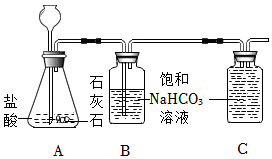 3.實驗室可用如圖裝置制取二氧化碳;已知常溫下CO2灘溶于飽和NaHCO3溶液。
3.實驗室可用如圖裝置制取二氧化碳;已知常溫下CO2灘溶于飽和NaHCO3溶液。
(1)寫出A裝置中發生反應的化學方程式。
(2)B中飽和碳酸氫鈉溶液的作用是什么?
(3)利用排飽和NaHCO3溶液法可以收集較純凈的二氧化碳氣體,請將C裝置中的導管補畫完整。發布:2024/12/25 15:0:2組卷:7引用:2難度:0.6
相關試卷


