 化學反應速率和限度與生產、生活密切相關。
化學反應速率和限度與生產、生活密切相關。
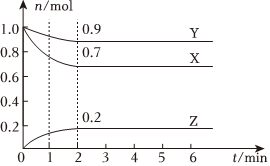
(1)某溫度下,2L恒容密閉容器中,X、Y、Z三種物質的物質的量隨反應時間的變化曲線如圖所示。
①從反應開始到2min內,用X的濃度變化表示的平均反應速率為 0.0750.075mol?L-1?min-1。
②該反應的化學方程式為 3X+Y?2Z3X+Y?2Z。
③1min時,正反應速率 >>(填“>”、“<”或“=”)逆反應速率。
④若X、Y、Z均為氣體,在2min時,向容器中通入氬氣(容器體積不變),X的反應速率將 不變不變(填“變大”、“不變”或“變小”)。
⑤若X、Y、Z均為氣體,下列能說明該反應達到平衡狀態的是 dd(填字母)。
a.X、Y、Z三種氣體的濃度相等
b.混合氣體的質量不隨時間變化
c.混合氣體的密度不隨時間變化
d.單位時間內消耗X和Z的物質的量之比為3:2
(2)實驗室用Na2S2O3溶液與H2SO4溶液反應探究條件的改變對化學反應速率的影響,設計的實驗方案如表(已知S2O2-3+2H+═SO2↑+S↓+H2O):
O
2
-
3
| 實驗序號 | 體積/mL | 溫度/℃ | 溶液出現渾濁的時間/s | ||
| 0.1mol/LNa2S2O3溶液 | 水 | 0.1mol/LH2SO4溶液 | |||
| 1 | 2.0 | 0.0 | 2.0 | 25 | t1 |
| 2 | 2.0 | 0.0 | 2.0 | 50 | t2 |
| 3 | 1.0 | V | 2.0 | T | t3 |
溫度
溫度
因素對化學反應速率的影響。②對比實驗1和3來探究濃度對化學反應速率的影響,則V=
1.0
1.0
,T=25
25
。若t1<t3,可得出:其他條件相同時,反應物濃度越大,反應速率越快
反應物濃度越大,反應速率越快
。【考點】化學平衡狀態的判斷;探究影響化學反應速率的因素.
【答案】0.075;3X+Y?2Z;>;不變;d;溫度;1.0;25;反應物濃度越大,反應速率越快
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:62引用:2難度:0.5
相似題
-
1.在一定溫度下的定容容器中,當下列哪些物理量不再發生變化時,表明反應A(g)+2B(g)?C(g)+D(g)已達到平衡狀態( )
①混合氣體的壓強
②混合氣體的密度
③B的物質的量濃度
④混合氣體的總物質的量
⑤混合氣體的平均相對分子質量
⑥v(C)與v(D)的比值
⑦混合氣體的總質量.A.②③④⑤⑥⑦ B.①③④⑤ C.①②③④⑤⑦ D.①③⑤ 發布:2024/12/30 19:30:2組卷:40引用:3難度:0.7 -
2.二甲醚(DME)一種清潔的替代燃料,不含硫,不會形成微粒,而且與汽油相比,排放的NO2更少,因此是優良的柴油機替代燃料。工業上利用一步法合成二甲醚的反應如下(復合催化劑為CuO/ZnO/Al2O2):
2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-204.7kJ/mol
(1)若反應在恒溫、恒壓下進行,以下敘述能說明該反應達到平衡狀態的是
A.CO和H2的物質的量濃度比是1:2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合氣體的體積保持不變
D.容器中混合氣體的平均摩爾質量保持不變
E.容器中混合氣體的密度保持不變
(2)600℃時,一步法合成二甲醚過程如下:
CO(g)+2H2(g)═CH3OH(g)△H1=-100.46kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2
CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-38.7kJ/mol
則△H2=。
(3)復合催化劑的制備方法之一是Na2CO3共沉淀法:制備1mol/L的硝酸銅,硝酸鋅和硝酸鋁的水溶液。然后向盛有去離子水的燒杯中同時滴加混合硝酸鹽溶液和1mol/L的Na2CO3水溶液,70℃下攪拌混合。沉淀后過濾,洗滌沉淀物,80℃下干燥12小時,然后500℃下焙燒16小時。
請寫出上述過程中硝酸鋁與Na2 CO3水溶液反應的離子方程式:
(4)以DME為燃料,氧氣為氧化劑,在酸性電解質溶液中用惰性電極制成燃料電池,則通入氧氣的電極是電源的(填正、負)極,通DME的電極反應為。發布:2025/1/3 8:0:1組卷:18引用:1難度:0.5 -
3.在一定溫度下的定容容器中,反應:A(s)+2B(g)?C(g)+D(g)。下列不能表明反應達到平衡狀態的是( )
A.氣體的壓強不變 B.氣體平均相對分子質量不變 C.v生成(B)═2v生成(C) D.B物質的物質的量濃度不變 發布:2024/12/30 19:0:1組卷:110引用:4難度:0.8


