某化學實驗小組的同學為探究和比較SO2和氯水的漂白性,設計了如下的實驗裝置.
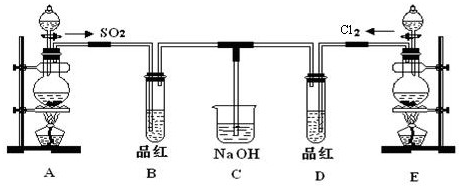
(1)實驗室用裝置A制備SO2.某同學在實驗時發現打開A的分液漏斗活塞后,漏斗中液體未流下,你認為原因可能是:分液漏斗的玻璃塞沒有取下來分液漏斗的玻璃塞沒有取下來;
(2)實驗室用裝置E制備Cl2,其反應的離子方程式為:MnO2+2Cl-+4H+ △ Mn2++Cl2↑+2H2OMnO2+2Cl-+4H+ △ Mn2++Cl2↑+2H2O.若有6mol的HCl參加反應,則轉移的電子總數為3×6.02×10233×6.02×1023;
(3)①反應開始一段時間后,觀察到B、D兩個試管中的品紅溶液出現的現象是:B:品紅褪色品紅褪色,D:品紅褪色品紅褪色.
②停止通氣后,再給B、D兩個試管分別加熱,兩個試管中的現象分別為B:褪色的品紅又恢復成紅色褪色的品紅又恢復成紅色,D:無明顯現象無明顯現象.
(4)另一個實驗小組的同學認為SO2和氯水都有漂白性,二者混合后的漂白性肯定會更強.他們將制得的SO2和Cl2按1:1同時通入到品紅溶液中,結果發現褪色效果并不像想象的那樣.請你分析該現象的原因(用離子方程式表示)Cl2+SO2+2H2O═4H++2Cl-+SO42-Cl2+SO2+2H2O═4H++2Cl-+SO42-.
△
△
【考點】探究氯水、氯氣的漂白作用.
【答案】分液漏斗的玻璃塞沒有取下來;MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O;3×6.02×1023;品紅褪色;品紅褪色;褪色的品紅又恢復成紅色;無明顯現象;Cl2+SO2+2H2O═4H++2Cl-+SO42-
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:642引用:15難度:0.1
相似題
-
1.某同學設計如圖所示裝置探究氯氣能否與水發生反應。已知氣體a的主要成分是含有少量水蒸氣的氯氣。請回答下列問題:

(1)濃硫酸的作用是。
(2)證明氯氣和水發生反應的實驗現象為。
(3)該實驗設計存在的缺陷是,為了克服該缺陷,需要補充裝置D,所用試劑為,其中發生反應的離子方程式為。發布:2024/6/27 10:35:59組卷:18引用:1難度:0.6 -
2.下面是某化學課外活動小組探索氯水漂白性的一個探究活動記錄.
【觀察】氯氣的顏色:黃綠色;氯水的顏色:黃綠色.
【結論】氯水中含有氯氣分子.
【實驗操作】用兩根玻璃棒分別蘸取鹽酸和氯水,各滴在兩片藍色石蕊試紙上.
【實驗現象】滴有鹽酸的試紙變紅,滴有氯水的試紙中間變為無色,外圈變紅.
【分析與結論】氯水呈黃綠色,說明氯水中溶有游離的氯氣分子,滴有氯水的藍色石蕊試紙外圈變紅,說明氯水中有能使試紙變紅的酸生成;中間變為無色,說明氯水中有能夠使有色物質褪色的物質生成.
【問題與思考】氯氣溶于水發生如下反應:Cl2+H2O═HCl+HClO,溶液中的水和鹽酸都沒有漂白作用,能夠使有色物質褪色的物質是氯水中的氯氣分子還是氯水中的次氯酸呢?還是二者都有漂白作用?
(1)氯水中所含的分子有,主要含有的分子是.
(2)氯水中所含的離子為.使藍色石蕊試紙變紅的離子為.使AgNO3溶液生成白色沉淀的化學方程式為.
(3)假設使藍色石蕊試紙褪色的是Cl2分子,請設計一個實驗驗證.
【實驗操作】.
【實驗現象】.
【分析與結論】.發布:2024/6/27 10:35:59組卷:48引用:1難度:0.9 -
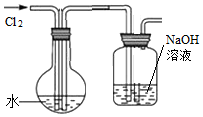 3.某學習小組用如圖所示裝置制取飽和氯水并探究飽和氯水的有關性質。
3.某學習小組用如圖所示裝置制取飽和氯水并探究飽和氯水的有關性質。
(1)證明氯水已經飽和的現象是。
(2)制取結束時,圓底燒瓶中的液體含有的分子有;含有的離子有(用微粒符號表示)。
(3)在氯水中加入鎂粉,觀察到有較多氣泡產生,反應的離子方程式為。
(4)用化學方程式表示氫氧化鈉溶液的作用。
(5)將新制的飽和氯水滴入含有酚酞的氫氧化鈉溶液中,溶液褪色。針對溶液褪色,小組同學有不同的意見,甲同學認為是氯水顯酸性中和了OH-使溶液褪色,乙同學則認為是氯水中次氯酸的漂白性使溶液褪色。大家激烈討論后,設計實驗進行證明。
請把實驗方案寫下來,要求有實驗步驟,現象和結論。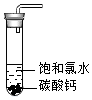
(6)飽和氯水與石灰石反應是制取較濃HClO溶液的方法之一。裝置如圖所示。
Ⅰ.在試管中加入過量的塊狀碳酸鈣,再加入約20mL飽和氯水,充分反應,開始有少量氣泡產生,隨后就無氣泡,溶液黃綠色褪去。
Ⅱ.過濾,將濾液滴在有色布條上,發現其比氯水的漂白性更強。
Ⅲ.為了確定反應產物,將濾液分為三份,分別進行以下實驗:
第一份與石灰水混合,立即產生大量白色沉淀;
第二份與稀鹽酸混合,立即產生大量無色氣體;
將第三份加熱,看到溶液變渾濁且有大量無色氣體產生。
經檢測,上述實驗中產生的無色氣體均為CO2氣體。
為什么實驗Ⅱ中濾液的漂白性更強了,請用文字簡要解釋;根據上述信息,請寫出該實驗中氯水與碳酸鈣反應的化學方程式(不考慮CO2的生成)。發布:2024/6/27 10:35:59組卷:99引用:1難度:0.5


