某課外活動(dòng)小組為了研究“干燥的CO2不能與Na2O2反應(yīng)”和“潮濕的CO2才能與Na2O2反應(yīng)”,設(shè)計(jì)了如圖實(shí)驗(yàn)裝置:

(1)寫(xiě)出過(guò)氧化鈉與CO2反應(yīng)的方程式,并用雙線橋表示該反應(yīng)的電子轉(zhuǎn)移情況 
 。
。
(2)打開(kāi)K1,關(guān)閉K2,打開(kāi)活塞加入稀硫酸,生成CO2,加熱銅絲,X是 濃硫酸濃硫酸。
(3)若打開(kāi)K2,關(guān)閉K1,硬質(zhì)玻璃管中出現(xiàn) 紅色銅絲變黑紅色銅絲變黑現(xiàn)象,可證明潮濕的CO2與Na2O2反應(yīng)產(chǎn)生了O2。某同學(xué)提出質(zhì)疑,認(rèn)為不一定是CO2與Na2O2反應(yīng)產(chǎn)生了O2導(dǎo)致該現(xiàn)象的產(chǎn)生,請(qǐng)用化學(xué)方程式解釋該同學(xué)提出質(zhì)疑的原因:2H2O+2Na2O2=4NaOH+O2↑2H2O+2Na2O2=4NaOH+O2↑。
(4)通過(guò)實(shí)驗(yàn)測(cè)得反應(yīng)結(jié)束后,球形干燥管中僅有Na2CO3和未反應(yīng)完的Na2O2固體,為測(cè)得固體混合物的組成,某實(shí)驗(yàn)小組將1.45g固體混合物溶于水中。然后向溶液中滴加鹽酸,產(chǎn)生氣體的體積隨鹽酸的加入量如圖所示。

①加入鹽酸0~100時(shí)間段,溶液中發(fā)生的離子反應(yīng)方程式有:Na2CO3+HCl=NaHCO3+NaClNa2CO3+HCl=NaHCO3+NaCl、4HCl+2Na2O2=4NaCl+O2↑+2H2O4HCl+2Na2O2=4NaCl+O2↑+2H2O。
②若在加入鹽酸體積為150時(shí),收集到CO2共0.44g,則固體混合物中Na2O2的質(zhì)量分?jǐn)?shù)為 26.9%26.9%。(保留一位小數(shù))


【考點(diǎn)】探究過(guò)氧化鈉與水的反應(yīng).
【答案】 ;濃硫酸;紅色銅絲變黑;2H2O+2Na2O2=4NaOH+O2↑;Na2CO3+HCl=NaHCO3+NaCl;4HCl+2Na2O2=4NaCl+O2↑+2H2O;26.9%
;濃硫酸;紅色銅絲變黑;2H2O+2Na2O2=4NaOH+O2↑;Na2CO3+HCl=NaHCO3+NaCl;4HCl+2Na2O2=4NaCl+O2↑+2H2O;26.9%
 ;濃硫酸;紅色銅絲變黑;2H2O+2Na2O2=4NaOH+O2↑;Na2CO3+HCl=NaHCO3+NaCl;4HCl+2Na2O2=4NaCl+O2↑+2H2O;26.9%
;濃硫酸;紅色銅絲變黑;2H2O+2Na2O2=4NaOH+O2↑;Na2CO3+HCl=NaHCO3+NaCl;4HCl+2Na2O2=4NaCl+O2↑+2H2O;26.9%【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:64引用:3難度:0.7
相似題
-
1.為探究Na2O2與H2O的反應(yīng),進(jìn)行了如圖實(shí)驗(yàn),下列說(shuō)法不正確的是( )
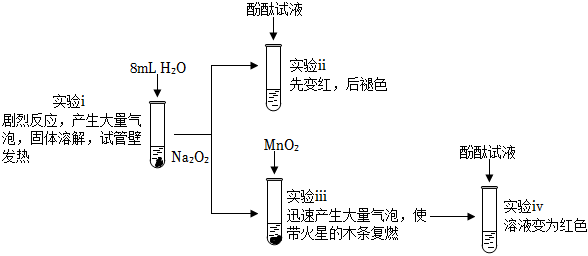
A.實(shí)驗(yàn)ⅰ中發(fā)生反應(yīng)的化學(xué)方程式為2Na2O2+2H2O═4NaOH+O2↑ B.實(shí)驗(yàn)ⅲ中MnO2做H2O2分解反應(yīng)的催化劑 C.綜合實(shí)驗(yàn)ⅰ和ⅲ可以說(shuō)明Na2O2與H2O反應(yīng)有H2O2生成 D.綜合實(shí)驗(yàn)ⅱ和ⅲ可以說(shuō)明使酚酞褪色的是O2 發(fā)布:2024/8/30 2:0:8組卷:7引用:2難度:0.7 -
2.某化學(xué)實(shí)驗(yàn)小組通過(guò)如圖所示實(shí)驗(yàn),探究Na2O2與水的反應(yīng)( )

下列說(shuō)法中不正確的是( )A.用玻璃棒蘸取②中的溶液點(diǎn)到PH試紙上,試紙變藍(lán) B.④中現(xiàn)象可能是由于溶液中含有強(qiáng)氧化性物質(zhì)造成的 C.⑤中MnO2的主要作用是降低了水中氧氣的溶解度 D.本實(shí)驗(yàn)中Na2O2與水反應(yīng)的總反應(yīng)為:2Na2O2+2H2O═4Na++4OH-+O2↑ 發(fā)布:2024/8/7 8:0:9組卷:42引用:1難度:0.5 -
3.探究Na2O2與水的反應(yīng),實(shí)驗(yàn)如圖:(已知:H2O2?H++
、HO-2?H++HO-2)下列分析不正確的是( )O2-2
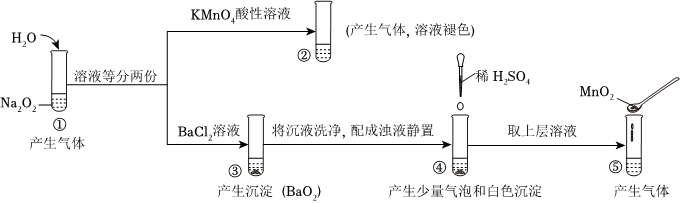
A.①、⑤中產(chǎn)生的氣體能使帶火星的木條復(fù)燃 B.①、④中均發(fā)生了氧化還原反應(yīng)和復(fù)分解反應(yīng) C.通過(guò)③能比較酸性:HCl>H2O2 D.②、⑤中KMnO4與MnO2的作用不同,產(chǎn)生氣體的量也不同 發(fā)布:2024/11/20 18:0:1組卷:243引用:4難度:0.7


