CO和N2O是汽車尾氣中污染大氣的成分。一定條件下,通過下列轉(zhuǎn)化反應(yīng):CO(g)+N2O(g)?CO2(g)+N2(g)(放熱反應(yīng)),可治理CO和N2O產(chǎn)生的污染。
向體積相同的三個(gè)恒容密閉容器中均充入amolCO(g)和amolN2O(g)進(jìn)行下列實(shí)驗(yàn):
| 實(shí)驗(yàn)序號(hào) | 反應(yīng)溫度 | 催化劑 |
| Ⅰ | 恒溫T1℃ | 無 |
| Ⅱ | 恒溫T1℃ | 有 |
| Ⅲ | 初始溫度T1℃,絕熱容器 | 無 |
回答下列問題:
(1)實(shí)驗(yàn)Ⅰ、Ⅱ中c(N2)隨時(shí)間t的變化曲線如圖,實(shí)驗(yàn)Ⅰ反應(yīng)開始至平衡時(shí)間段內(nèi)v(N2O)=
0
.
5
t
2
0
.
5
t
2
等于
等于
實(shí)驗(yàn)Ⅱ(填“大于”“小于”或“等于”)。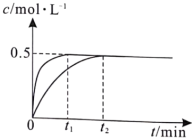
(2)某時(shí)刻向?qū)嶒?yàn)Ⅱ容器充入一定量X(g),使容器內(nèi)壓強(qiáng)增大。
①若X是CO(g),則反應(yīng)速率
變大
變大
(填“變大”“變小”或“不變”);②若X是Ar(g)(不參與反應(yīng)),則反應(yīng)速率
不變
不變
(填“變大”“變小”或“不變”)。(3)下列敘述能說明轉(zhuǎn)化反應(yīng)到達(dá)平衡狀態(tài)的有
BC
BC
(填標(biāo)號(hào))。A.v(CO2)=v(CO)
B.?dāng)嗔裯molN≡N同時(shí)生成nmolCO2
C.
c
(
N
2
O
)
c
(
N
2
)
D.v正(N2O)=2v逆(CO)
E.氣體的平均摩爾質(zhì)量不變
(4)反應(yīng)一段時(shí)間后,發(fā)現(xiàn)實(shí)驗(yàn)Ⅲ中反應(yīng)速率增大,其原因是
反應(yīng)體系是絕熱系統(tǒng),該反應(yīng)放熱,會(huì)使體系升溫,從而加快反應(yīng)速率
反應(yīng)體系是絕熱系統(tǒng),該反應(yīng)放熱,會(huì)使體系升溫,從而加快反應(yīng)速率
。(5)轉(zhuǎn)化反應(yīng)CO(g)+N2O(g)?CO2(g)+N2(g),在Fe+的催化作用下反應(yīng)歷程可分為:
第一步:Fe++N2O(g)═FeO++N2(g);
第二步:FeO++
CO(g)
CO(g)
=Fe+
Fe+
+CO2(g)
CO2(g)
(將化學(xué)方程式補(bǔ)充完整)。【考點(diǎn)】物質(zhì)的量或濃度隨時(shí)間的變化曲線;化學(xué)平衡狀態(tài)的判斷.
【答案】;等于;變大;不變;BC;反應(yīng)體系是絕熱系統(tǒng),該反應(yīng)放熱,會(huì)使體系升溫,從而加快反應(yīng)速率;CO(g);Fe+;CO2(g)
0
.
5
t
2
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:59引用:2難度:0.7
相似題
-
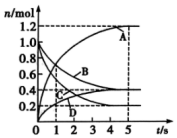 1.一定溫度下,向容積為2L的密閉容器中通入兩種氣體發(fā)生化學(xué)反應(yīng),反應(yīng)中各物質(zhì)的物質(zhì)的量變化如圖所示。則下列對該反應(yīng)的推斷合理的是( )
1.一定溫度下,向容積為2L的密閉容器中通入兩種氣體發(fā)生化學(xué)反應(yīng),反應(yīng)中各物質(zhì)的物質(zhì)的量變化如圖所示。則下列對該反應(yīng)的推斷合理的是( )A.該反應(yīng)的化學(xué)方程式為6A+2D?3B+4C B.0~1s內(nèi),v(A)=v(B) C.5s時(shí),v(A)=v(B)=v(C)=v(D) D.0~5s內(nèi),B的平均反應(yīng)速率為0.06mol/(L?s) 發(fā)布:2024/12/30 19:30:2組卷:32引用:3難度:0.7 -
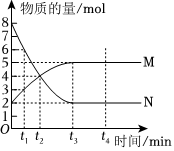 2.一定溫度下,在容積為VL的密閉容器中進(jìn)行反應(yīng):aN(g)?bM(g),M、N的物質(zhì)的量隨時(shí)間的變化曲線如圖所示,下列說法錯(cuò)誤的是( )
2.一定溫度下,在容積為VL的密閉容器中進(jìn)行反應(yīng):aN(g)?bM(g),M、N的物質(zhì)的量隨時(shí)間的變化曲線如圖所示,下列說法錯(cuò)誤的是( )A.此反應(yīng)的化學(xué)方程式中a:b=2:1 B.t3時(shí)刻該反應(yīng)達(dá)到化學(xué)平衡 C.當(dāng)混合氣體的總質(zhì)量不隨時(shí)間的變化而變化時(shí)反應(yīng)達(dá)到平衡狀態(tài) D.任意時(shí)刻都滿足v(N)正=2v(M)正 發(fā)布:2024/12/30 14:30:1組卷:17引用:2難度:0.7 -
3.一定溫度下,在容積為2L的密閉容器中,與同一個(gè)化學(xué)反應(yīng)有關(guān)的A、B、C、D(其中A、B、C均為氣體)四種物質(zhì)的物質(zhì)的量隨反應(yīng)時(shí)間的變化如圖所示。E為該反應(yīng)的另一種氣態(tài)生成物,且在化學(xué)方程式中E的化學(xué)計(jì)量數(shù)與B的相同。請回答下列問題:
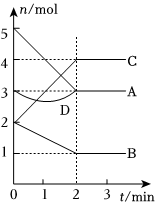
(1)該反應(yīng)的反應(yīng)物為。
(2)0~2min內(nèi),v(C)=,v(E)=。
(3)若降低溫度,則v(正)(填“加快”、“減慢”或“不變”,下同),v(逆)。
(4)該反應(yīng)達(dá)到平衡狀態(tài)的標(biāo)志有。(填序號(hào))
a.A和C的物質(zhì)的量相等
b.B的物質(zhì)的量保持不變
c.A的正反應(yīng)速率與B的逆反應(yīng)速率之比為2:1
d.容器內(nèi)壓強(qiáng)不變
(5)物質(zhì)D在反應(yīng)中的作用是。發(fā)布:2024/12/30 14:30:1組卷:10引用:3難度:0.7
相關(guān)試卷


