用如圖所示實驗裝置探究銅絲與過量濃硫酸的反應。
(1)寫出A中發生反應的化學方程式 Cu+2H2SO4(濃) △ SO2↑+CuSO4+2H2OCu+2H2SO4(濃) △ SO2↑+CuSO4+2H2O。
(2)裝置B中氯水是由氯氣溶于水制得,高錳酸鉀固體與濃鹽酸可制取氯氣,MnO4-變成Mn2+,寫出反應的離子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O。
(3)為驗證SO2和Cl2發生了反應,小組同學進行如下實驗。
①甲同學認為若SO2和Cl2反應,生成了Cl-,只要檢驗到生成的Cl-即可,甲取適量B中樣品于試管中,向其中滴加少量 AgNO3AgNO3溶液,有白色沉淀生成。
②乙同學認為甲同學的結論不合理,理由是 Cl2和水反應也會生成Cl-Cl2和水反應也會生成Cl-。他認為若驗證SO2和Cl2反應,需要檢驗到生成的 SO42-SO42-。
③一段時間后,觀察到B中溶液黃綠色褪去,B中反應的離子方程式為 SO2+2H2O+Cl2=4H++SO42-+2Cl-SO2+2H2O+Cl2=4H++SO42-+2Cl-。
(4)C中反應的化學方程式為 SO2+2H2S=3S↓+2H2OSO2+2H2S=3S↓+2H2O。
(5)裝置E中發生反應的離子方程式是 SO2+2OH-=SO32-+H2OSO2+2OH-=SO32-+H2O。
(6)研究小組認為可以用H2O2溶液來驗證E中溶液含有SO32-,進行了實驗i。
△
△
| 實驗序號 | 操作 | 現象 |
| i | a.取少量E中溶液,向其中加入適量H2O2溶液,振蕩,觀察。 | 無明顯現象 |
| b.然后滴加 鹽酸 鹽酸 ,振蕩,觀察。 |
無明顯現象 | |
| c.再滴加 BaCl2溶液 BaCl2溶液 ,振蕩,觀察。 |
白色沉淀 |
鹽酸
鹽酸
、BaCl2溶液
BaCl2溶液
。(7)研究小組反思實驗方案i不夠嚴謹,設計了對比實驗:取E中溶液,直接進行操作b、c,不產生白色沉淀/沉淀量明顯小于實驗i從而結合實驗i,證明了E中含有SO32-。對比實驗方案的目的是
排除空氣中氧氣對驗證方案的干擾
排除空氣中氧氣對驗證方案的干擾
。【考點】濃硫酸的性質實驗.
【答案】Cu+2H2SO4(濃) SO2↑+CuSO4+2H2O;2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;AgNO3;Cl2和水反應也會生成Cl-;SO42-;SO2+2H2O+Cl2=4H++SO42-+2Cl-;SO2+2H2S=3S↓+2H2O;SO2+2OH-=SO32-+H2O;鹽酸;BaCl2溶液;鹽酸;BaCl2溶液;排除空氣中氧氣對驗證方案的干擾
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:20引用:1難度:0.5
相似題
-
1.下列依據實驗方案和現象對濃硫酸性質做出的判斷合理的是( )
實驗方案 實驗I: 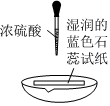
實驗Ⅱ: 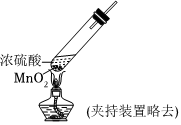
實驗現象 試紙中心區域變黑,邊緣變紅 黑色固體溶解,溶液接近無色(溶液中錳元素僅以Mn2+存在),產生能使帶火星的木條復燃的無色氣體 A.由Ⅰ可知,濃硫酸具有脫水性 B.由Ⅰ可知,濃硫酸具有弱酸性 C.由Ⅱ可知,濃硫酸具有強氧化性 D.由Ⅱ可知,濃硫酸具有吸水性 發布:2024/12/30 11:30:1組卷:167引用:6難度:0.5 -
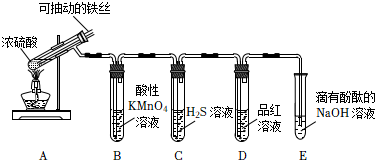 2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質,設計如圖所示裝置進行實驗,下列說法錯誤的是( )
2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質,設計如圖所示裝置進行實驗,下列說法錯誤的是( )A.實驗結束后,可取A中試管內的溶液稀釋后滴加KSCN溶液檢驗是否有Fe3+ B.B中溶液紫色褪去,C中生成淡黃色沉淀,均體現了SO2的還原性 C.D中品紅溶液褪色,體現了SO2的漂白性 D.E中溶液紅色變淺,體現了SO2酸性氧化物的性質 發布:2024/12/30 14:0:1組卷:115引用:3難度:0.7 -
3.某小組同學探究濃硫酸的性質,向試管①、②中加入等量的98%的濃硫酸,實驗如下。下列對實驗的分析不合理的是( )
實驗1 實驗2 實驗3 裝置 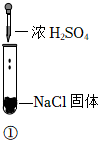
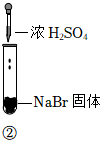
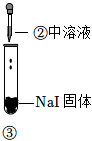
現象 溶液顏色無明顯變化;把蘸濃氨水的玻璃棒靠近試管口,產生白煙 溶液變黃;把濕潤的品紅試紙靠近試管口,試紙褪色 溶液變深紫色(經檢驗溶液含單質碘) A.實驗1中,白煙是NH4Cl B.根據實驗1和實驗2判斷還原性:Br->Cl- C.根據實驗3判斷還原性:I->Br- D.上述實驗體現了濃H2SO4的強氧化性、難揮發性等性質 發布:2024/12/30 7:30:1組卷:190引用:5難度:0.7


