工業(yè)上用Cu(NH3)4SO4和氨水的混合液浸取廢銅礦渣中的單質(zhì)銅,得到[Cu(NH3)2]2SO4.某小組同學(xué)欲通過實(shí)驗(yàn)探究其原理。
【查閱資料】i.[Cu(NH3)4]2+呈深藍(lán)色,[Cu(NH3)4]2+?Cu2++4NH3;受熱易分解,放出氨氣。
ii.Cu+在水溶液中不穩(wěn)定,Cu(I)在溶液中只能以[Cu(NH3)2]+等絡(luò)合離子的形式穩(wěn)定存在;[Cu(NH3)2]+無色,易被氧氣氧化為[Cu(NH3)4]2+。
【實(shí)驗(yàn)1】制備Cu(NH3)4SO4。
向盛有2mL 0.1mol/L CuSO4溶液的試管中滴加2mL 1mol/L氨水,觀察到溶液中立即出現(xiàn)淺藍(lán)色沉淀;隨后沉淀逐漸溶解,得到深藍(lán)色溶液。經(jīng)分離得到Cu(NH3)4SO4晶體。
(1)資料表明,向CuSO4溶液中滴加氨水,可能會(huì)生成淺藍(lán)色Cu2(OH)2SO4沉淀。
①該小組同學(xué)取實(shí)驗(yàn)1中淺藍(lán)色沉淀,洗滌后,先加入過量稀鹽酸,再加入BaCl2溶液,觀察到有白色沉淀產(chǎn)生先加入過量稀鹽酸,再加入BaCl2溶液,觀察到有白色沉淀產(chǎn)生(補(bǔ)全實(shí)驗(yàn)操作和現(xiàn)象),證明沉淀中含有SO2-4。
②補(bǔ)全實(shí)驗(yàn)1中生成Cu2(OH)2SO4沉淀的離子方程式:2Cu2++2NH3?H2O2NH3?H2O+SO2-4═Cu2(OH)2SO4↓+2NH+42NH+4。
(2)甲同學(xué)設(shè)計(jì)實(shí)驗(yàn)證明深藍(lán)色溶液中含Cu(NH3)4SO4:加熱深藍(lán)色溶液并檢驗(yàn)逸出氣體為氨氣。你認(rèn)為此方案 不可行不可行(填“可行”或“不可行”),理由是 實(shí)驗(yàn)1中氨水過量,過量的氨水受熱分解也會(huì)產(chǎn)生氨氣實(shí)驗(yàn)1中氨水過量,過量的氨水受熱分解也會(huì)產(chǎn)生氨氣。
【實(shí)驗(yàn)2】探究用Cu(NH3)4SO4和氨水的混合液浸取單質(zhì)銅得到[Cu(NH3)2]2SO4的原理。
SO
2
-
4
SO
2
-
4
NH
+
4
NH
+
4
| 編號(hào) | 實(shí)驗(yàn)裝置及部分操作 | 燒杯中溶液 | 實(shí)驗(yàn)現(xiàn)象 |
| 2-1 | 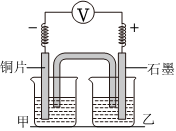 實(shí)驗(yàn)開始,先讀取電壓表示數(shù),后迅速將其換成電流表,繼續(xù)實(shí)驗(yàn),10 min內(nèi)記錄甲燒杯中現(xiàn)象 |
甲:0.05mol/LNa2SO4 乙:0.05mol/LCu(NH3)4SO4 |
電壓表指針迅速偏轉(zhuǎn)至0.1V;甲中溶液無明顯變化 |
| 2-2 | 甲:0.05mol/LNa2SO4 乙:0.05mol/LCuSO4 |
電壓表指針迅速偏轉(zhuǎn)至0.3V;甲中溶液無明顯變化 | |
| 2-3 | 甲:0.1mol/LNa2SO4與1mol/L氨水等體積混合 乙:溶液A |
電壓表指針迅速偏轉(zhuǎn)至0.35V;甲中溶液無明顯變化 | |
| 2-4 | 甲:0.1mol/LNa2SO4與1mol/L氨水等體積混合 乙:0.05mol/LCuSO4 |
電壓表指針迅速偏轉(zhuǎn)至0.65V;幾分鐘后,甲燒杯溶液逐漸由無色變藍(lán)色 |
(3)溶液A為
0.05mol/LCu(NH3)4SO4溶液
0.05mol/LCu(NH3)4SO4溶液
。(4)對(duì)比實(shí)驗(yàn)2-1和2-2,可以得到結(jié)論是
相同條件下,Cu(NH3)4SO4的氧化性弱于CuSO4
相同條件下,Cu(NH3)4SO4的氧化性弱于CuSO4
。(5)實(shí)驗(yàn)2-4中,甲燒杯中溶液由無色變?yōu)樗{(lán)色的原因是
Cu-e-+2NH3=[Cu(NH3)2]+,[Cu(NH3)2]+被空氣中的氧氣氧化為藍(lán)色[Cu(NH3)4]2+
Cu-e-+2NH3=[Cu(NH3)2]+,[Cu(NH3)2]+被空氣中的氧氣氧化為藍(lán)色[Cu(NH3)4]2+
。(6)依據(jù)上述實(shí)驗(yàn),分析用Cu(NH3)4SO4和氨水的混合液浸取單質(zhì)銅的原理:
[Cu(NH3)4]2+將Cu氧化為[Cu(NH3)2]+,氨水對(duì)浸取單質(zhì)銅的反應(yīng)有促進(jìn)作用
[Cu(NH3)4]2+將Cu氧化為[Cu(NH3)2]+,氨水對(duì)浸取單質(zhì)銅的反應(yīng)有促進(jìn)作用
。【考點(diǎn)】銅鹽;性質(zhì)實(shí)驗(yàn)方案的設(shè)計(jì).
【答案】先加入過量稀鹽酸,再加入BaCl2溶液,觀察到有白色沉淀產(chǎn)生;2NH3?H2O;2;不可行;實(shí)驗(yàn)1中氨水過量,過量的氨水受熱分解也會(huì)產(chǎn)生氨氣;0.05mol/LCu(NH3)4SO4溶液;相同條件下,Cu(NH3)4SO4的氧化性弱于CuSO4;Cu-e-+2NH3=[Cu(NH3)2]+,[Cu(NH3)2]+被空氣中的氧氣氧化為藍(lán)色[Cu(NH3)4]2+;[Cu(NH3)4]2+將Cu氧化為[Cu(NH3)2]+,氨水對(duì)浸取單質(zhì)銅的反應(yīng)有促進(jìn)作用
NH
+
4
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:84引用:2難度:0.5
相似題
-
1.將32.0g的Cu片投入到150mL某濃度的HNO3溶液中,恰好完全反應(yīng),共收集到11.2L(標(biāo)準(zhǔn)狀況下)NO2和NO的混合氣體,則該HNO3的物質(zhì)的量濃度為( )
A.10.0mol/L B.6.70mol/L C.13.3mol/L D.8.60mol/L 發(fā)布:2024/12/30 3:30:1組卷:34引用:3難度:0.6 -
2.我國宋代沈括在《夢(mèng)溪筆談》中記載:“信州鉛山縣有苦泉,流以為澗。挹其水熬之,則成膽礬。熬膽礬鐵釜,久之亦化為銅。”下列對(duì)文中加點(diǎn)詞語的理解,正確的是( )
A.“苦泉”中泉水屬于膠體 B.“熬”表示加熱蒸餾 C.“膽礬”化學(xué)式為CuSO4 D.“化”表示置換轉(zhuǎn)化 發(fā)布:2024/11/12 8:0:1組卷:221引用:2難度:0.9 -
 3.銅、錳及其合金是人類常用的金屬材料.
3.銅、錳及其合金是人類常用的金屬材料.
(1)向一定物質(zhì)的量濃度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀經(jīng)高溫灼燒,可制得CuMn2O4.
①寫出基態(tài)Mn原子的價(jià)電子排布式為.
②CO32-的空間構(gòu)型是(用文字描述).
(2)在銅錳氧化物的催化下,CO被氧化為CO2,HCHO被氧化為CO2和H2O.
①根據(jù)等電子體原理,CO分子的結(jié)構(gòu)式為.
②CO2分子中C原子軌道的雜化類型為.
③1 mol甲醛(HCHO)分子中所含σ鍵的數(shù)目為.
(3)科學(xué)家通過X射線推測(cè)膽礬中既含有配位鍵,又含有氫鍵,其結(jié)構(gòu)示意圖可簡(jiǎn)單表示如圖:
①膽礬的化學(xué)式用配合物的形式表示為.
②膽礬中SO42-的空間構(gòu)型為,H2O中O原子的雜化類型為.發(fā)布:2024/11/12 8:0:1組卷:8引用:1難度:0.3
相關(guān)試卷


