某小組同學探究物質的溶解度大小與沉淀轉化方向之間的關系。已知:
| 物質 | BaSO4 | BaCO3 | AgI | AgCl |
| Ksp(25℃) | 1.1×10-10 | 2.6×10-9 | 8.5×10-17 | 1.8×10-10 |
AgCl(s)?Ag+(aq)+Cl-(aq)
AgCl(s)?Ag+(aq)+Cl-(aq)
。②25℃時,若使Ag+沉淀完全(濃度小于1×10-5mol?L-1即視為沉淀完全),則溶液中Cl-的濃度至少為
1.8×10-5
1.8×10-5
mol?L-1。(2)探究BaCO3和BaSO4之間的轉化
實驗操作:
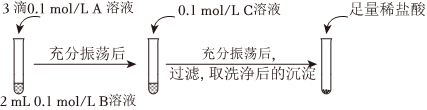
| 試劑A | 試劑B | 試劑C | 加入鹽酸后的現象 | |
| 實驗Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | ?????? |
| 實驗Ⅱ | Na2SO4 | Na2CO3 | 有少量氣泡產生,沉淀部分溶解 |
沉淀不溶解(或無明顯現象)
沉淀不溶解(或無明顯現象)
。②實驗Ⅱ中加入稀鹽酸后發生反應的離子方程式是
BaCO3+2H+═Ba2++CO2↑+H2O
BaCO3+2H+═Ba2++CO2↑+H2O
。③實驗Ⅱ說明沉淀發生了部分轉化,結合BaSO4的沉淀溶解平衡解釋原因
BaSO4在溶液中存在BaSO4(s)?Ba2+(aq)+(aq),當加入濃度較高的Na2CO3溶液,與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動
SO
2
-
4
CO
2
-
3
BaSO4在溶液中存在BaSO4(s)?Ba2+(aq)+(aq),當加入濃度較高的Na2CO3溶液,與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動
。SO
2
-
4
CO
2
-
3
(3)探究AgCl和AgI之間的轉化
實驗Ⅲ:
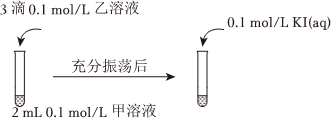
可供選擇的試劑有:a.AgNO3溶液、b.NaCl溶液、c.KI溶液
①若要用實驗Ⅲ證明AgCl能夠轉化為AgI,甲溶液可以是
b
b
(填上方試劑的序號)。應用實驗Ⅲ的方式,無論怎樣選擇試劑,同學們都無法觀察到AgI轉化為AgCl,于是又設計了如下實驗。
實驗Ⅳ:
| 裝置 | 步驟 | 電壓表讀數 |
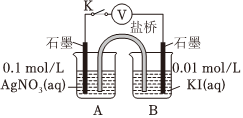 |
i.如圖連接裝置并加入試劑,閉合K | a |
| ii.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| iv.重復i,再向B中加入與i等量NaCl(s) | a |
[2]電壓表讀數:a>c>b>0。
②實驗Ⅳ的步驟中,B燒杯中石墨上的電極反應式是
2I--2e-═I2
2I--2e-═I2
。③結合信息,解釋實驗Ⅳ中b<a的原因:
生成AgI沉淀使B中c(I-)減小,I-還原性減弱
生成AgI沉淀使B中c(I-)減小,I-還原性減弱
。④實驗Ⅳ的現象能說明AgI轉化為AgCl,理由是
實驗ⅳ表明Cl-本身對該原電池電壓無影響,c>b說明加入Cl-使溶液中c(I-)增大,證明發生了AgI+Cl-?AgCl+I-
實驗ⅳ表明Cl-本身對該原電池電壓無影響,c>b說明加入Cl-使溶液中c(I-)增大,證明發生了AgI+Cl-?AgCl+I-
。綜合實驗Ⅰ~Ⅳ,可得出結論:溶解度小的沉淀容易轉化成溶解度更小的沉淀,反之則不易;溶解度差別越大,由溶解度小的沉淀轉化為溶解度較大的沉淀越難實現。
【考點】沉淀溶解平衡.
【答案】AgCl(s)?Ag+(aq)+Cl-(aq);1.8×10-5;沉淀不溶解(或無明顯現象);BaCO3+2H+═Ba2++CO2↑+H2O;BaSO4在溶液中存在BaSO4(s)?Ba2+(aq)+(aq),當加入濃度較高的Na2CO3溶液,與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動;b;2I--2e-═I2;生成AgI沉淀使B中c(I-)減小,I-還原性減弱;實驗ⅳ表明Cl-本身對該原電池電壓無影響,c>b說明加入Cl-使溶液中c(I-)增大,證明發生了AgI+Cl-?AgCl+I-
SO
2
-
4
CO
2
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:40引用:1難度:0.6
相似題
-
1.已知常溫下:KsP(AgCl白色)=1.8×10-10,KsP(Ag2S黑色)=2.0×10-48 KsP(Ag2CrO4紅色)=1.9×10-12,下列敘述正確的是( )
A.向AgCl的懸濁液中加入NaBr溶液,白色沉淀轉化為淡黃色,說明KSP(AgCl)<KSP(AgBr) B.將0.001mol?L-1 AgNO3溶液滴入0.001mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液中,先產生Ag2CrO4沉淀 C.向AgCl的懸濁液中滴加濃氨水,沉淀溶解,說明AgCl的溶解平衡向右移動 D.測定水體中氯化物的含量,常用標準硝酸銀法進行滴定,滴定時,應加入的指示劑為K2S 發布:2024/12/30 8:0:1組卷:10引用:0難度:0.9 -
2.鐵器表面氧化層的成分有多種:致密的Fe3O4、疏松的FeO(OH)和FeOCl,它們均難溶于水.下列說法錯誤的是( )
A.有氧條件下Fe3O4與Cl-轉化為FeOCl,周圍環境的pH增大 B.FeOCl可自發轉變為FeO(OH),說明FeO(OH)的溶解度小于FeOCl C.檢驗FeO(OH)中是否含有FeOCl,可選用的試劑是稀硫酸和KSCN溶液 D.1molFeOCl完全轉化為Fe3O4時轉移 mol電子13發布:2024/12/19 13:30:1組卷:62引用:3難度:0.5 -
3.高中化學《化學反應原理》模塊從不同的視角對化學反應進行了探究、分析,以下觀點中不正確的是( )
A.難溶電解質在水中達到溶解平衡時,再加入難溶電解質,溶液中各離子濃度不變 B.將TiCl4加入水中并加熱使其轉化為TiO2?xH2O C.乙烯聚合為聚乙烯的反應是熵減的過程,卻能夠自發進行,可知該反應的ΔH<0 D.NaHCO3溶液顯堿性的原因: +H2O?CO 32-+H3O+HCO-3發布:2024/12/30 10:30:1組卷:10引用:4難度:0.7


