 某興趣小組在實驗室里準備常見酸、堿、鹽的性質(zhì)實驗時,發(fā)現(xiàn)實驗臺上擺放的藥品中有一瓶未蓋瓶塞且標簽破損的溶液(如圖),他們決定對這瓶溶液的成分進行探究。
某興趣小組在實驗室里準備常見酸、堿、鹽的性質(zhì)實驗時,發(fā)現(xiàn)實驗臺上擺放的藥品中有一瓶未蓋瓶塞且標簽破損的溶液(如圖),他們決定對這瓶溶液的成分進行探究。
【提出問題】這瓶溶液的溶質(zhì)是什么?
【獲得信息】
(1)酸、堿、鹽的性質(zhì)實驗中用到含鈉元素的物質(zhì)有氯化鈉、氫氧化鈉、碳酸鈉、碳酸氫鈉。
(2)實驗室里盛放堿性溶液的試劑瓶通常使用橡膠塞。
(3)碳酸氫鈉溶液與氯化鋇溶液不反應;氯化鋇溶液呈中性。
【提出猜想】
猜想一:氫氧化鈉;
猜想二:碳酸鈉;
猜想三:碳酸氫鈉。
【實驗探究】
(1)小軍取樣滴加稀鹽酸有 氣泡氣泡產(chǎn)生,得出結論;該溶液的溶質(zhì)是碳酸鈉或者是 碳酸氫鈉碳酸氫鈉。
(2)小軍另取樣加入過量的氯化鋇溶液,觀察到有 白色沉淀白色沉淀產(chǎn)生,進而得出結論:該溶液的溶質(zhì)是碳酸鈉。
(3)小華認為小軍的結論不完全正確,理由是 2NaOH+CO2=Na2CO3+H2O2NaOH+CO2=Na2CO3+H2O(用化學方程式表示)。小組同學討論后一致認為還需要進行如下實驗。
(4)取小軍第二次實驗后的上層清液,滴入無色酚酞試液,溶液呈紅色。
【實驗結論】這瓶溶液的原溶質(zhì)是 氫氧化鈉氫氧化鈉。
【探究啟示】實驗中取用液體藥品時,應注意 標簽朝向手心(或取用完畢后立即密封瓶塞)標簽朝向手心(或取用完畢后立即密封瓶塞)(答一點)。
【答案】氣泡;碳酸氫鈉;白色沉淀;2NaOH+CO2=Na2CO3+H2O;氫氧化鈉;標簽朝向手心(或取用完畢后立即密封瓶塞)
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:180引用:9難度:0.4
相似題
-
1.倉庫中有一包氮肥的包裝標簽模糊不清,有同學進行了以下探究:
(1)操作③用玻璃棒攪拌的目的是.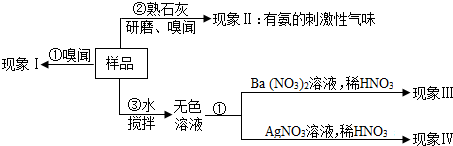
(2)請完成如表(已知AgCl和BaSO4是難溶于水和酸的白色固體):
(3)若現(xiàn)象Ⅲ、Ⅳ都無現(xiàn)象,則該氮肥可能是假設和現(xiàn)象 判斷和化學方程式 a 若現(xiàn)象I為無氨味. 則樣品中不含 (填名稱).b 由操作②現(xiàn)象判斷. 該樣品一定含有 離子.c 若現(xiàn)象Ⅲ為白色沉淀,現(xiàn)象Ⅳ為無沉淀. 則樣品中含有 (寫名稱),該反應的化學方程式為.d 若現(xiàn)象Ⅲ為“無沉淀”,現(xiàn)象Ⅳ為白色沉淀. 則樣品中含有 (寫化學式),該反應的化學方程式為.(寫化學式);若操作②現(xiàn)象為無氣味、現(xiàn)象Ⅲ、Ⅳ無現(xiàn)象,則該氮肥可能是(只寫一種).發(fā)布:2024/12/24 11:1:11組卷:356引用:5難度:0.1 -
 2.某化學興趣小組的同學在整理化學藥品柜時【提出問題】這瓶無色溶液是什么物質(zhì)的溶液?
2.某化學興趣小組的同學在整理化學藥品柜時【提出問題】這瓶無色溶液是什么物質(zhì)的溶液?
【查閱資料】①20℃是碳酸鈉的溶解度是21.8g,碳酸氫鈉的溶解度是9.6g,硫酸鈉的溶解度19.5g,硝酸鈉的溶解度是88g。
②碳酸鋇是不溶于水的白色固體,硫酸鋇是既不溶解于水又不溶解于酸的白色固體;
③Ca(OH)2和Ba(OH)2的不同溫度下的溶解度如表所示:
【猜想與假設】小組同學提出了如下假設:溫度(℃) 10 20 30 40 50 60 Ca(OH)2 0.17g 0.16g 0.15g 0.14g 0.13g 0.12g Ba(OH)2 2.48g 3.89g 5.59g 8.22g 13.12g 20.94g
①碳酸鈉溶液;②硫酸鈉溶液;③碳酸氫鈉溶液;④硝酸鈉溶液
【討論交流】在老師的指導下,小組同學認為假設不合理,理由是。
【進行實驗】小組同學設計并進行了如下實驗,請你完善小組同學的“相互評價”。
【實驗反思】請寫出硫酸鈉和氫氧化鋇反應的化學方程式實驗組別 操作、現(xiàn)象與結論 結論與評價 第一組 取少量的樣品溶液于一試管中,向其中加入稀鹽酸,試管中無明顯現(xiàn)象。猜想②成立。 你認為此結論 (填“正確”或不正確”),理由是。第二組 取少量的樣品溶液于一試管中,向其中加入氫氧化鋇溶液,試管中出現(xiàn)白色沉淀。猜想②成立。 此結論不正確,要想進一步確定猜想②成立,還需進行的實驗是 。。
【注意:若答對下列兩個小題獎勵4分,化學試卷總分不超過60分】
【拓展提升】長期存放的氫氧化鈉溶液會變質(zhì)生成碳酸鈉,為探究氫氧化鈉變質(zhì)的程度,實驗室常用先加過量的氯化鈣溶液或氯化鋇溶液充分反應后過濾,再在濾液中滴加酚酞溶液的方案進行實驗。
【實驗反思】實驗發(fā)現(xiàn)加氯化鋇溶液比加氯化鈣溶液實驗結果更準確,原因是。如果使用氯化鈣溶液,要達到實驗目的,你認為改進實驗的方法是。發(fā)布:2024/12/25 16:30:1組卷:91引用:2難度:0.5 -
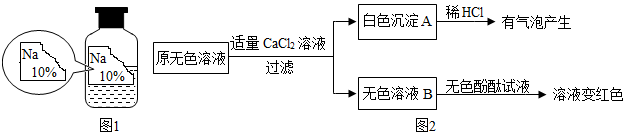
3.實驗室有一瓶標簽殘缺并且瓶蓋沒有完全密封的無色溶液(如圖1),化學小組的同學經(jīng)過詢問老師后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一種溶液,為確認原瓶中是何種溶質(zhì)并判斷其是否變質(zhì),化學小組的同學進行了如下的探究活動:
【進行猜想】
猜想I:原溶液的溶質(zhì)是NaCl;
猜想Ⅱ:原溶液的溶質(zhì)是NaOH;
猜想Ⅲ:原溶液的溶質(zhì)是Na2CO3;
猜想 IV:原溶液的溶質(zhì)是NaHCO3。
【查閱資料】常溫下,有關物質(zhì)的相關信息如表:
從物質(zhì)的相關信息可知,原溶液的溶質(zhì)一定不是NaHCO3,因為物質(zhì) NaCl NaOH Na2CO3 NaHCO3 常溫下的溶解度/g 36 109 21.5 9.6 常溫下稀溶液的pH 7 13 11 9 。
【進行實驗】
(1)取少量樣品,測得溶液的pH大于7,則原溶液的溶質(zhì)肯定不是。
(2)同學們另取樣品又進行了如下實驗,實驗過程如圖2:
①生成白色沉淀A的化學方程式。
②通過實驗可以判斷樣品無色溶液中含有的溶質(zhì)有
【獲得結論】
實驗完成后,最終得到的結論:原瓶中的溶質(zhì)是,且已變質(zhì)。發(fā)布:2024/12/25 16:0:1組卷:142引用:5難度:0.5


