某學習小組為認識鐵及其化合物的性質、分散系的性質做了如圖一組綜合實驗,根據實驗流程回答相關問題:
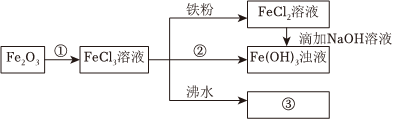
(1)請寫出Fe2O3與①反應的離子方程式 Fe2O3+6H+═2Fe3++3H2OFe2O3+6H+═2Fe3++3H2O。
(2)請寫出FeCl3與鐵粉反應的化學方程式 Fe+2FeCl3═3FeCl2Fe+2FeCl3═3FeCl2。
(3)向FeCl2溶液中滴加NaOH溶液最終生成Fe(OH)3濁液,該過程的現象為 生成白色沉淀,迅速變成灰綠色,最終變成紅褐色生成白色沉淀,迅速變成灰綠色,最終變成紅褐色,此過程中發生的氧化還原反應為 4Fe(OH)2+O2+2H2O═4Fe(OH)34Fe(OH)2+O2+2H2O═4Fe(OH)3(用化學方程式表達)。
(4)將FeCl3飽和溶液滴入沸水中,并繼續煮沸至紅褐色,此過程中發生的化學反應為 FeCl3+3H2O △ Fe(OH)3(膠體)+3HClFeCl3+3H2O △ Fe(OH)3(膠體)+3HCl(用化學方程式表達)。
(5)FeCl2溶液能使酸性高錳酸鉀溶液褪色,生成二價錳離子,此過程中發生的化學反應為 5Fe2++10Cl-+3MnO-4+24H+=3Mn2++5Fe3++3Cl2↑+12H2O5Fe2++10Cl-+3MnO-4+24H+=3Mn2++5Fe3++3Cl2↑+12H2O(用離子方程式表達)。
△
△
M
n
O
-
4
M
n
O
-
4
【考點】鐵及其化合物的相互轉化;鐵的化學性質.
【答案】Fe2O3+6H+═2Fe3++3H2O;Fe+2FeCl3═3FeCl2;生成白色沉淀,迅速變成灰綠色,最終變成紅褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3;FeCl3+3H2O Fe(OH)3(膠體)+3HCl;5Fe2++10Cl-+3+24H+=3Mn2++5Fe3++3Cl2↑+12H2O
△
M
n
O
-
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:222引用:1難度:0.7
相似題
-
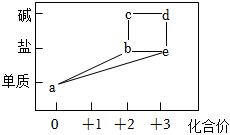 1.部分含鐵物質的分類與相應化合價關系如圖所示.下列推斷不合理的是( )
1.部分含鐵物質的分類與相應化合價關系如圖所示.下列推斷不合理的是( )A.a可與e反應生成b B.b既可被氧化,也可被還原 C.可將e加入濃堿液中制得d的膠體 D.可存在b→c→d→e→b的循環轉化關系 發布:2024/12/10 1:30:1組卷:263引用:14難度:0.7 -
2.下列有關常見元素及其化合物的相關轉化,在指定條件下均能實現的是( )
A.Fe FeCl3Cl2△FeCl2CuB.NaCl(aq) Na(s)電解Na2O2(s)O2點燃C.SiO2(aq) H2SiO3(s)H2ONa2SiO3(aq)NaOH(aq)D.SO2 BaSO3BaCl2(aq)BaSO4O2發布:2024/10/24 8:0:1組卷:24引用:4難度:0.7 -
3.FeCl3為棕褐色固體,在化工生產中有許多應用。
(1)26Fe元素有54Fe、546Fe、57Fe、58Fe四種核素,它們互為,54Fe的中子數為,1個56Fe原子的質量是。
(2)書寫利用單質反應制備氯化鐵的化學方程式,并標出電子轉移的方向和數目:。
(3)氯化鐵溶于水后,電離方程式為。檢驗氯化鐵溶液中的溶質負離子的操作、現象和結論是:。
(4)將少量飽和FeCl3溶液分別滴加到下列物質中,得到三種分散系甲、乙、丙。用紅色水平分別照射分散系甲和丙,現象的差異為:。向丙中加入少量稀鹽酸,會出現和乙中相同的現象,原因是:。
(5)5.410g氯化鐵晶體(FeCl3?6H2O)與100mLAgNO3溶液恰好完全沉淀,則AgNO3溶液的物質的量濃度為。
(6)若用氯化鐵晶體(FeCl3?6H2O)配制100mL1.000mol?L-1FeCl3溶液,下列會造成所配溶液物質的量濃度偏高的是。(雙選)
A.定容時,俯視凹液面最低點
B.轉移時,有少量液體濺出
C.FeCl3晶體已部分失水
D.燒杯、玻璃棒未洗滌
(7)將飽和氯化鐵溶液與小蘇打溶液混合時,會產生紅褐色沉淀和一種無色無味且能使石灰水變渾濁的氣體,則該氣體在標況下的密度為。(保留三位小數)發布:2024/10/7 9:0:2組卷:40引用:1難度:0.7


