 過碳酸鈉(2Na2CO3?3H2O2),是一種新型高效環保的固體漂白殺菌劑,易溶于水,微溶于異丙醇,在高溫、高濕或存在重金屬離子和其他雜質污染時,容易發生分解反應,導致活性氧含量(即殺菌消毒時產生的氧氣質量占過碳酸鈉的質量分數)降低.制備過碳酸鈉的實驗裝置如圖,請回答以下問題:
過碳酸鈉(2Na2CO3?3H2O2),是一種新型高效環保的固體漂白殺菌劑,易溶于水,微溶于異丙醇,在高溫、高濕或存在重金屬離子和其他雜質污染時,容易發生分解反應,導致活性氧含量(即殺菌消毒時產生的氧氣質量占過碳酸鈉的質量分數)降低.制備過碳酸鈉的實驗裝置如圖,請回答以下問題:
(1)相比分液漏斗,滴液漏斗的優點是 平衡滴液漏斗與三頸燒瓶的氣壓,便于漏斗內液體順利流下平衡滴液漏斗與三頸燒瓶的氣壓,便于漏斗內液體順利流下.
(2)制備過碳酸鈉反應的化學方程式為 2Na2CO3+3H2O2 冰鹽浴 2Na2CO3?3H2O22Na2CO3+3H2O2 冰鹽浴 2Na2CO3?3H2O2.
(3)制備過程中最適宜的溫度是5℃,當溫度過高時產率迅速下降,原因是 溫度過高會加快過氧化氫和過碳酸鈉的分解溫度過高會加快過氧化氫和過碳酸鈉的分解.
(4)反應結束后可采用結晶法從溶液中分離出過碳酸鈉,請簡述該操作步驟:往三頸燒瓶中滴加適量的異丙醇,待充分結晶后過濾、洗滌、干燥往三頸燒瓶中滴加適量的異丙醇,待充分結晶后過濾、洗滌、干燥.
(5)氧化還原滴定法是以溶液中氧化劑和還原劑之間的電子轉移為基礎的一種滴定分析方法,應用非常廣泛.某小組利用該原理測定過碳酸鈉的活性氧含量.實驗步驟:稱取0.1g試樣于250mL錐形瓶中,加入60mL水使之溶解,再加入15mL2mol?L-1H2SO4溶液,用0.01mol?L-1KMnO4標準溶液滴定.重復該操作4次,達到滴定終點時消耗KMnO4標準溶液的體積分別為20.20mL、20.15mL、21.45mL、20.25mL.
①滴定時,酸性高錳酸鉀溶液盛裝在 酸式酸式(填“酸式”或“堿式”)滴定管,原因是 酸性KMnO4溶液具有強氧化性,會腐蝕堿式滴定管的橡膠酸性KMnO4溶液具有強氧化性,會腐蝕堿式滴定管的橡膠.
②實驗達到滴定終點的現象是 當滴入最后半滴酸性KMnO4溶液時,錐形瓶中的溶液為由無色變為粉紅色且30s內不褪色當滴入最后半滴酸性KMnO4溶液時,錐形瓶中的溶液為由無色變為粉紅色且30s內不褪色.
③根據實驗數據,計算該試樣中活性氧含量為 8.08%8.08%.
④下列操作將導致計算的活性氧含量偏高的是 ABAB(填標號).
A.到達滴定終點,仰視滴定管讀數
B.滴定結束后,滴定管尖嘴處懸掛一滴液體
C.滴定前滴定管中沒有氣泡,滴定后有氣泡
D.在滴定時搖晃錐形瓶過于劇烈,有少量溶液濺出
冰鹽浴
冰鹽浴
【考點】制備實驗方案的設計;探究物質的組成或測量物質的含量.
【答案】平衡滴液漏斗與三頸燒瓶的氣壓,便于漏斗內液體順利流下;2Na2CO3+3H2O2 2Na2CO3?3H2O2;溫度過高會加快過氧化氫和過碳酸鈉的分解;往三頸燒瓶中滴加適量的異丙醇,待充分結晶后過濾、洗滌、干燥;酸式;酸性KMnO4溶液具有強氧化性,會腐蝕堿式滴定管的橡膠;當滴入最后半滴酸性KMnO4溶液時,錐形瓶中的溶液為由無色變為粉紅色且30s內不褪色;8.08%;AB
冰鹽浴
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:22引用:2難度:0.5
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
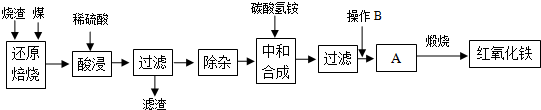
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗
Fe3+已經除盡的試劑是.
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則操作B是.
(5)煅燒A的反應方程式是.
(6)a g燒渣經過上述工藝可得紅氧化鐵b g.藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示).發布:2025/1/19 8:0:1組卷:5引用:1難度:0.5 -
2.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如圖:
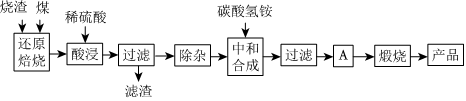
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,檢驗Fe3+已經除盡的試劑是;當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.
(5)a g燒渣經過上述工藝可得紅氧化鐵b g.藥典標準規定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質量分數應不低于(用含a、b的表達式表示).發布:2025/1/19 8:0:1組卷:114引用:4難度:0.5 -
3.硫鐵礦燒渣是硫鐵礦生產硫酸過程中產生的工業廢渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等雜質).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
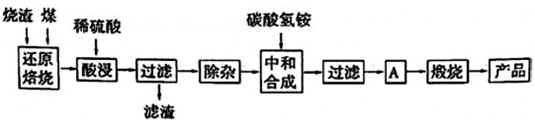
(1)在“還原焙燒”中產生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據下表數據:
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常溫下,當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉變為碳酸亞鐵沉淀,則A的操作是.發布:2025/1/19 8:0:1組卷:12引用:1難度:0.5


