生活中常見酸、堿、鹽的性質(zhì)、應用、制法是化學研究的主要內(nèi)容。
(1)隨著新能源汽車的發(fā)展,動力電池領域?qū)溲趸嚨男枨罅吭絹碓酱蟆溲趸嚕↙iOH)與氫氧化鈉化學性質(zhì)相似,其原因是溶液中都有OH-OH-(填離子符號)。
(2)圖1是碳酸鈉溶液與稀鹽酸反應的微觀示意圖。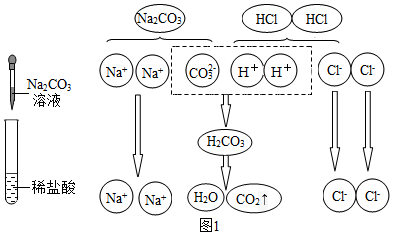
由圖可知,該化學反應的微觀實質(zhì)是氫離子與碳酸根離子反應生成水和二氧化碳氣體氫離子與碳酸根離子反應生成水和二氧化碳氣體。
(3)海水中有豐富的化學資源。從海水中提取鎂、制“堿”,都體現(xiàn)了人類改造物質(zhì)的智慧。結合圖2流程圖(其中部分操作和條件已略去),請回答相關問題:
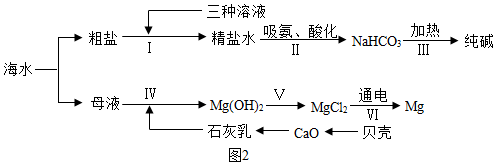
①從海水中獲得的粗鹽中含有的SO42-、Ca2+、Mg2+等雜質(zhì),為獲得精鹽,設計了如下操作:a.溶解;b.加過量的Na2CO3溶液;c.加過量的BaCl2溶液;d.加適量的鹽酸;e.加過量NaOH溶液;f.蒸發(fā)結晶;g.過濾。正確的操作順序是a→e→c→b→g→dc→b→g→d→f(填序號)。
②步驟Ⅱ中先向飽和食鹽水中通入氨氣,有利于二氧化碳的吸收,寫出該反應的化學方程式:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4ClNH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。
③步驟Ⅳ中驗證母液中MgCl2已完全轉(zhuǎn)化為Mg(OH)2沉淀的方法是取樣品,加入氫氧化鈣溶液,如果沒有沉淀產(chǎn)生則MgCl2已完全轉(zhuǎn)化為Mg(OH)2取樣品,加入氫氧化鈣溶液,如果沒有沉淀產(chǎn)生則MgCl2已完全轉(zhuǎn)化為Mg(OH)2。
【答案】OH-;氫離子與碳酸根離子反應生成水和二氧化碳氣體;c→b→g→d;NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;取樣品,加入氫氧化鈣溶液,如果沒有沉淀產(chǎn)生則MgCl2已完全轉(zhuǎn)化為Mg(OH)2
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/5/23 20:38:36組卷:47引用:2難度:0.8
相似題
-
1.Na2CO3俗稱純堿,NaOH俗稱燒堿,它們都是白色粉末。請回答下列問題。
(1)能區(qū)別Na2CO3和NaOH兩種溶液的方法是(填序號)。
①加入澄清石灰水
②加入食鹽水
③滴入無色酚酞溶液
④加入稀鹽酸
(2)敞口放置的燒堿會吸收空氣中的而變質(zhì),反應的化學方程式為。要檢驗NaOH是否變質(zhì),可選用的方法是。 (填序號)
①加入澄清石灰水
②加入氯化鈣溶液
③滴入無色酚酞溶液
④加入稀鹽酸
(3)純堿可與CO2和H2O反應生成NaHCO3,該反應的化學方程式為,Na2CO3與稀鹽酸反應放出CO2,但實驗室卻不用這個反應制取CO2,其主要原因可能是;已知在某溫度下,Na2CO3的溶解度比NaHCO3大,則該溫度時,向飽和Na2CO3溶液中連續(xù)通入CO2,可觀察到的現(xiàn)象是。發(fā)布:2025/1/3 8:0:1組卷:4引用:2難度:0.5 -
2.下列物質(zhì)不能與氯化鋇溶液發(fā)生反應的是( )
A.硫酸銅 B.硝酸銀 C.氯化鈣 D.碳酸鈉 發(fā)布:2024/12/25 17:0:2組卷:68引用:3難度:0.5 -
3.蛋白質(zhì)是組成細胞的基礎物質(zhì),沒有蛋白質(zhì)就沒有生命.人體內(nèi)的血紅蛋白、各種酶都是蛋白質(zhì).一些可溶性的重金屬鹽(如Cu2+、Ba2+、Ag+等的可溶性鹽)與蛋白質(zhì)作用會使蛋白質(zhì)凝固變性,從而喪失其生理功能危及生命.因此,可溶性重金屬鹽為有毒物質(zhì),根據(jù)上述所給知識,用化學式回答下列問題:
(1)CuSO4、AgNO3、Ba(NO3)2、AgCl四種物質(zhì)中,無毒的是;
(2)在醫(yī)療上用X射線檢查胃腸疾病時,讓病人服用硫酸鋇的懸濁液(俗稱鋇餐),而不能服用碳酸鋇,其原因是人體胃液中含有一定量的,與碳酸鋇反應后,產(chǎn)生了一定量的使人中毒的氯化鋇,其反應的化學方程式是.
(3)若因氯化鋇中毒,下列方案中可作為最佳解毒措施的是(填序號).
A、多飲糖水;B、飲用純堿溶液;C、飲用食鹽水;D、飲用硫酸鈉溶液.發(fā)布:2024/12/25 17:30:2組卷:48引用:17難度:0.7


