某化學課堂圍繞“酸堿中和反應”,在老師引導下開展探究活動,某同學向盛有氫氧化鈉溶液的小燒杯中滴加稀硫酸,沒有觀察到現象。他發現自己在滴加稀硫酸前忘了加入酸堿指示劑,導致無法判斷反應情況,于是他對試管中溶液的酸堿性進行探究。
【探究目的】探究反應后溶液的酸堿性
【實驗原理】小燒杯中發生反應的化學方程式為 2NaOH+H2SO4=Na2SO4+2H2O2NaOH+H2SO4=Na2SO4+2H2O。
【猜想】猜想一:氫氧化鈉未完全反應,溶液呈堿性。
猜想二:氫氧化鈉和稀硫酸恰好完全反應,溶液呈中性。
猜想三:氫氧化鈉完全反應,稀硫酸過量,溶液呈酸性。
【實驗過程】
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取少量反應后溶液于試管中,滴入1~2滴無色酚酞溶液,振蕩 | 溶液變 紅 紅 色 |
溶液呈堿性 |
| 溶液不變色 | 溶液呈 中性或酸性 中性或酸性 |
FeCl3+3NaOH=3NaCl+Fe(OH)3↓
FeCl3+3NaOH=3NaCl+Fe(OH)3↓
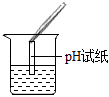
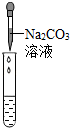
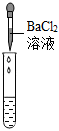
。(2)若滴入酚酞后溶液不變色,為進一步確定溶液的酸堿性,該同學選用了老師提供的pH試紙、Na2CO3溶液、BaCl2溶液,進行如下三個方案的探究。
| 實驗方案 | 測溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 實驗操作 |
|
|
|
| 實驗現象 | 試紙變色,對比比色卡,pH<7 |
有氣泡產生 有氣泡產生
|
產生白色沉淀 |
| 實驗結論 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【評價反思】老師對該同學能用多種方法進行探究得出正確結論給予肯定,同時指出(2)中存在兩處明顯錯誤,請大家反思,同學們經過反思發現了如下兩處錯誤:
(3)實驗操作中的錯誤是
方案一中pH試紙直接伸入待測液中
方案一中pH試紙直接伸入待測液中
;(4)實驗方案中也有一個是錯誤的,用化學方程式說明錯誤的原因:
BaCl2+Na2SO4=2NaCl+BaSO4↓
BaCl2+Na2SO4=2NaCl+BaSO4↓
。【考點】中和反應及其應用.
【答案】2NaOH+H2SO4=Na2SO4+2H2O;紅;中性或酸性;FeCl3+3NaOH=3NaCl+Fe(OH)3↓;有氣泡產生;方案一中pH試紙直接伸入待測液中;BaCl2+Na2SO4=2NaCl+BaSO4↓
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:116引用:2難度:0.7
相似題
-
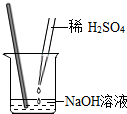 1.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )
1.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )A.無色 B.紅色 C.紫色 D.藍色 發布:2024/12/25 17:0:2組卷:68引用:3難度:0.9 -
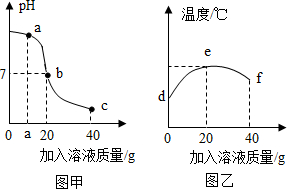 2.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )
2.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )A.當加入20g氫氧化鈉溶液時恰好完全反應 B.a點時溶液中的溶質為氫氧化鈉和氯化鈉 C.溫度上升是由于中和反應放熱,溫度下降是因為增加液體 D.e點時溶液中的溶質為氯化鈉 發布:2024/12/25 17:0:2組卷:71引用:3難度:0.6 -
3.某研究性學習小組為了探究氫氧化鈉溶液與稀硫酸是否恰好完全反應,分別取少量反應后的溶液于試管中,用下表中的不同試劑進行實驗.下列選項正確的是( )
選項 所用試劑 現象和結論 A 硫酸銅溶液 出現藍色沉淀,則氫氧化鈉過量 B 氯化鋇溶液 出現白色沉淀,則硫酸過量 C 銅絲 有氣泡產生,則硫酸過量 D 無色酚酞溶液 溶液不變色,則恰好完全反應 A.A B.B C.C D.D 發布:2024/12/25 17:30:2組卷:46引用:2難度:0.7


