在溫度t1和t2下,X2(g)和H2反應生成HX的平衡常數如下表:
| 化學方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
放熱
放熱
反應(填“吸熱”或“放熱”)。(2)HX的電子式是


(3)共價鍵的極性隨共用電子對偏移程度的增大而增強,HX共價鍵的極性由強到弱的順序是
HF、HCl、HBr、HI
HF、HCl、HBr、HI
。(4)X2都能與H2反應生成HX,用原子結構解釋原因:
鹵素原子的最外層電子數均為7
鹵素原子的最外層電子數均為7
。(5)K的變化體現出X2化學性質的遞變性,用原子結構解釋原因:
同一主族元素從上到下原子核外電子層數依次增多
同一主族元素從上到下原子核外電子層數依次增多
,原子半徑逐漸增大,得電子能力逐漸減弱。(6)僅依據K的變化,可以推斷出:隨著鹵素原子核電荷數的增加,
ad
ad
(選填字母)。a.在相同條件下,平衡時X2的轉化率逐漸降低
b.X2與H2反應的劇烈程度逐漸減弱
c.HX的還原性逐漸減弱
d.HX的穩定性逐漸減弱。
【答案】放熱; ;HF、HCl、HBr、HI;鹵素原子的最外層電子數均為7;同一主族元素從上到下原子核外電子層數依次增多;ad
;HF、HCl、HBr、HI;鹵素原子的最外層電子數均為7;同一主族元素從上到下原子核外電子層數依次增多;ad
 ;HF、HCl、HBr、HI;鹵素原子的最外層電子數均為7;同一主族元素從上到下原子核外電子層數依次增多;ad
;HF、HCl、HBr、HI;鹵素原子的最外層電子數均為7;同一主族元素從上到下原子核外電子層數依次增多;ad【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:182引用:6難度:0.7
相似題
-
1.下列曲線表示鹵族元素某種性質隨核電荷數的變化趨勢,正確的是( )
A. 
B. 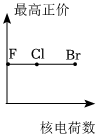
C. 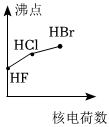
D.  發布:2024/12/30 3:0:4組卷:75引用:22難度:0.8
發布:2024/12/30 3:0:4組卷:75引用:22難度:0.8 -
2.對于鹵族元素的氫化物性質比較中,排序錯誤的是( )
A.沸點:HF>HI>HBr>HCl B.穩定性:HF>HCl>HBr>HI C.還原性:HI>HBr>HCl>HF D.酸性:HF>HCl>HBr>HI 發布:2024/12/30 10:30:1組卷:5引用:2難度:0.7 -
3.下列曲線表示鹵素元素某種性質隨核電荷數的變化趨勢,正確的是( )
A. 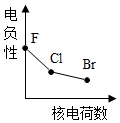
B. 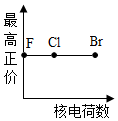
C. 
D.  發布:2024/12/30 15:30:1組卷:108引用:26難度:0.9
發布:2024/12/30 15:30:1組卷:108引用:26難度:0.9


