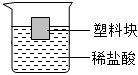
 在盛有稀鹽酸大燒杯中,漂浮著一個(gè)塑料塊,如圖所示。現(xiàn)向稀鹽酸中加入適量的碳酸鈣粉末。請(qǐng)分析:充分反應(yīng)后,塑料塊排開液體的體積如何變化?并用科學(xué)原理加以解析。(不計(jì)溶液體積的變化)
在盛有稀鹽酸大燒杯中,漂浮著一個(gè)塑料塊,如圖所示。現(xiàn)向稀鹽酸中加入適量的碳酸鈣粉末。請(qǐng)分析:充分反應(yīng)后,塑料塊排開液體的體積如何變化?并用科學(xué)原理加以解析。(不計(jì)溶液體積的變化)
【考點(diǎn)】中和反應(yīng)及其應(yīng)用.
【答案】塑料塊處于漂浮狀態(tài),則G=F浮=ρ液gV排,現(xiàn)在向稀鹽酸中加入適量的碳酸鈣粉末,鹽酸和碳酸鈣反應(yīng)生成氯化鈣、水和二氧化碳?xì)怏w,氯化鈣的相對(duì)分子質(zhì)量比氯化氫大,則反應(yīng)后溶液的濃度變大,在浮力不變的前提下,溶液密度變大,根據(jù)F浮=ρ液gV排知現(xiàn)在則塑料塊排開液體的體積會(huì)變小。
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:15引用:1難度:0.5
相似題
-
1.電導(dǎo)率是衡量溶液導(dǎo)電能力大小的物理量,在相同條件下,電導(dǎo)率與離子濃度(單位體積內(nèi)的離子數(shù))成正比,鹽酸和氫氧化鈉反應(yīng)電導(dǎo)率曲線如圖所示,以下分析不正確的是( )
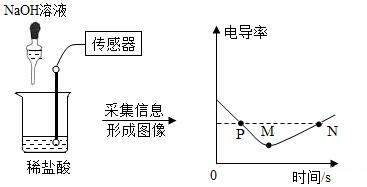
A.電導(dǎo)率減小可能是由于溶液中離子數(shù)量逐漸減小 B.M點(diǎn)時(shí)NaOH溶液與稀鹽酸恰好完全反應(yīng) C.N點(diǎn)時(shí)溶液中的離子數(shù)大于P點(diǎn) D.該實(shí)驗(yàn)證明溶液中始終含有帶電的粒子 發(fā)布:2024/12/28 15:30:1組卷:78引用:6難度:0.5 -
2.向盛有50g 10% Ba(OH)2溶液的燒杯中慢慢滴加稀硫酸至過量,如圖(縱坐標(biāo)表示燒杯中其他量的變化)所有有關(guān)量的變化與所加入稀硫酸質(zhì)量的關(guān)系錯(cuò)誤的是( )
A. 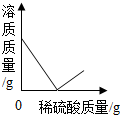
B. 
C. 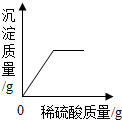
D. 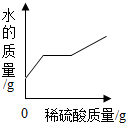 發(fā)布:2024/12/28 15:30:1組卷:15引用:4難度:0.5
發(fā)布:2024/12/28 15:30:1組卷:15引用:4難度:0.5 -
3.等質(zhì)量的氫氧化鈉溶液和稀鹽酸混合后,若所得溶液pH=7,則( )
A.所用氫氧化鈉溶液和稀鹽酸的溶質(zhì)質(zhì)量分?jǐn)?shù)相等 B.混合溶液中鈉離子與氯離子個(gè)數(shù)相等 C.混合前后水分子總數(shù)不變 D.混合前后陽離子總數(shù)不變 發(fā)布:2024/12/28 15:0:1組卷:134引用:10難度:0.5


