食用堿的主要成分是Na2CO3(含有少量NaCl)。某小組為測定食用堿中Na2CO3的含量,設計了如圖實驗裝置(固定裝置已略去)。
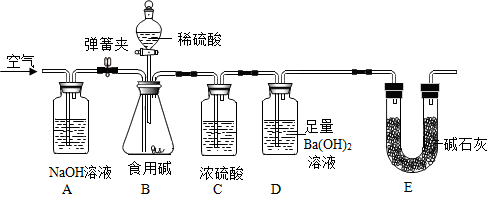
設計思路:用空氣將裝置B中生成的二氧化碳緩緩吹入裝置D中,利用裝置D的質量變化測定食用堿中Na2CO3的含量。請結合實驗裝置和設計思路,回答下面問題:
(1)裝置D中發生反應的化學方程式為Ba(OH)2+CO2=BaCO3↓+H2OBa(OH)2+CO2=BaCO3↓+H2O;
(2)若空氣通入太快,會導致測定結果偏大偏大(填“偏大”或“偏小”);
(3)裝置A的作用是吸收空氣中的二氧化碳吸收空氣中的二氧化碳;
(4)若沒有C裝置,會導致測定結果偏大偏大(填“偏大”或“偏小”)。
【答案】Ba(OH)2+CO2=BaCO3↓+H2O;偏大;吸收空氣中的二氧化碳;偏大
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:93引用:2難度:0.8
相似題
-
1.Na2CO3俗稱純堿,NaOH俗稱燒堿,它們都是白色粉末。請回答下列問題。
(1)能區別Na2CO3和NaOH兩種溶液的方法是(填序號)。
①加入澄清石灰水
②加入食鹽水
③滴入無色酚酞溶液
④加入稀鹽酸
(2)敞口放置的燒堿會吸收空氣中的而變質,反應的化學方程式為。要檢驗NaOH是否變質,可選用的方法是。 (填序號)
①加入澄清石灰水
②加入氯化鈣溶液
③滴入無色酚酞溶液
④加入稀鹽酸
(3)純堿可與CO2和H2O反應生成NaHCO3,該反應的化學方程式為,Na2CO3與稀鹽酸反應放出CO2,但實驗室卻不用這個反應制取CO2,其主要原因可能是;已知在某溫度下,Na2CO3的溶解度比NaHCO3大,則該溫度時,向飽和Na2CO3溶液中連續通入CO2,可觀察到的現象是。發布:2025/1/3 8:0:1組卷:4引用:2難度:0.5 -
2.下列物質不能與氯化鋇溶液發生反應的是( )
A.硫酸銅 B.硝酸銀 C.氯化鈣 D.碳酸鈉 發布:2024/12/25 17:0:2組卷:68引用:3難度:0.5 -
3.蛋白質是組成細胞的基礎物質,沒有蛋白質就沒有生命.人體內的血紅蛋白、各種酶都是蛋白質.一些可溶性的重金屬鹽(如Cu2+、Ba2+、Ag+等的可溶性鹽)與蛋白質作用會使蛋白質凝固變性,從而喪失其生理功能危及生命.因此,可溶性重金屬鹽為有毒物質,根據上述所給知識,用化學式回答下列問題:
(1)CuSO4、AgNO3、Ba(NO3)2、AgCl四種物質中,無毒的是;
(2)在醫療上用X射線檢查胃腸疾病時,讓病人服用硫酸鋇的懸濁液(俗稱鋇餐),而不能服用碳酸鋇,其原因是人體胃液中含有一定量的,與碳酸鋇反應后,產生了一定量的使人中毒的氯化鋇,其反應的化學方程式是.
(3)若因氯化鋇中毒,下列方案中可作為最佳解毒措施的是(填序號).
A、多飲糖水;B、飲用純堿溶液;C、飲用食鹽水;D、飲用硫酸鈉溶液.發布:2024/12/25 17:30:2組卷:48引用:17難度:0.7


