硝酸是一種具有強氧化性、腐蝕性的強酸,其還原產物因硝酸濃度的不同而有變化,從總體上說,硝酸濃度越高,平均每分子硝酸得到的電子數越少,濃硝酸的還原產物主要為NO2、稀硝酸的還原產物為NO。實驗室中,常用Cu與濃HNO3反應制取NO2,用Cu與稀HNO3反應制取NO。
(1)濃硝酸具有以下性質:
①強氧化性
②酸性
③還原性
④不穩定性
⑤揮發性
下列反應或者現象主要體現了硝酸的什么性質:
①久置濃硝酸顯黃色 ④④(填序號,下同)。
②用稀硝酸清洗試管壁上的銀 ①②①②。
③稀硝酸清洗石灰水試劑瓶壁上的固體 ②②。
(2)請寫出實驗室中用Cu與稀HNO3反應制取NO的化學方程式并用雙線橋標明電子的轉移方向及數目 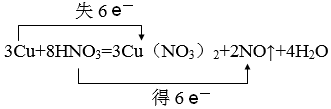
 。
。
(3)64gCu與適量的濃HNO3反應,銅全部作用后,共收集到22.4L氣體(標準狀況下),反應中消耗的HNO3的物質的量是 DD。(填字母代號)
A.0.5mol
B.1.0mol
C.2.0mol
D.3.0mol
(4)硝酸的還原產物NO、NO2、N2O等對環境均有副作用,為了可持續發展,當今社會提出的一個新概念--“綠色化學”,它要求從經濟、環保和技術上設計可行的化學反應,則下列由單質銅制取硝酸銅的方法可行且符合“綠色化學”的是 BB。(填字母代號)
A.CuHNO3Cu(NO3)2
B.CuO2CuOHNO3Cu(NO3)2
C.CuO2CuOH2OCu(OH)2HNO3Cu(NO3)2
D.CuH2SO4CuSO4Ba(NO3)2Cu(NO3)2
(5)實際上硝酸不僅可被還原為NO2或NO,濃度更稀時硝酸還可以被還原為N2O、N2、NH4NO3等,鋅與很稀的硝酸反應生成硝酸鋅、硝酸銨和水。寫出該反應的化學方程式 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O,當生成amol硝酸鋅時,被還原的硝酸的物質的量為 a4mola4mol。


HN
O
3
O
2
HN
O
3
O
2
H
2
O
HN
O
3
H
2
S
O
4
B
a
(
N
O
3
)
2
a
4
a
4
【考點】硝酸的化學性質.
【答案】④;①②;②; ;D;B;4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;mol
;D;B;4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;mol
 ;D;B;4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;
;D;B;4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;a
4
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:83引用:3難度:0.7
相似題
-
1.有關硝酸化學性質的敘述中,正確的是( )
A.硝酸能與Na2CO3、Na2S、Na2SO3等鹽反應,產生CO2、H2S和SO2 B.硝酸與FeO反應生成Fe(NO3)2和水,與Fe反應生成Fe(NO3)2和H2 C.濃硝酸、稀硝酸都只能使藍色石蕊試紙變紅 D.濃硝酸因分解放出的NO2又溶解于濃硝酸而使之呈黃色 發布:2024/12/30 5:0:1組卷:53引用:5難度:0.7 -
2.下列有關化學反應的敘述正確的是( )
A.常溫下Cu和濃硫酸反應生成CuSO4 B.過量的Fe與稀硝酸反應生成Fe(NO3)2 C.光照條件下,甲苯和Cl2反應生成鄰氯甲苯 D.加熱條件下,溴乙烷與NaOH水溶液反應生成乙烯 發布:2025/1/3 17:30:5組卷:28引用:1難度:0.7 -
3.稀HNO3還原產物可以是:①NO、②N2O、③N2、④NH4NO3.在稀HNO3和Zn的反應中,若有1mol HNO3參加反應,則有0.8mol電子轉移,由此推斷稀HNO3的還原產物為( )
A.僅④ B.②和④ C.③和④ D.僅② 發布:2024/12/30 4:30:1組卷:97引用:5難度:0.9


